توجه: این یک مقاله علمی در مورد گال است، چنانچه نیازمند اطلاعات عمومی در مورد بیماری گال هستید، مطالعه مقاله ” گال چیست؟ ” پیشنهاد میشود.
مقدمه
گال یک بیماری پوستی انگلی واگیر است که توسط کنه انسانی Sarcoptes scabiei var. hominis ایجاد میشود. این کنه داخل لایه شاخی پوست نفوذ کرده و منجر به ایجاد التهاب، خارش شدید، و ضایعات پوستی متعددی میشود. گال یکی از بیماریهای گرمسیری نادیدهگرفتهشده است که عمدتاً در جوامع پرجمعیت و با سطح پایین بهداشت دیده میشود، و بار قابلتوجهی بر سلامت عمومی بهویژه در کشورهای در حال توسعه وارد میکند. اگرچه این بیماری قابل درمان است، اما در صورت عدم تشخیص بهموقع، میتواند به اپیدمیهای موضعی و بروز عوارض ثانویه منجر شود.
با وجود شیوع بالا، تشخیص گال همچنان یک چالش بالینی و اپیدمیولوژیک محسوب میشود. روشهای رایج شامل بررسی میکروسکوپی ضایعات پوستی یا مشاهده مستقیم کنه یا تخم آن هستند. این روشها به دلیل حساسیت پایین، نیاز به اپراتور آموزشدیده، و احتمال بالای نتایج منفی کاذب، کارایی محدودی دارند. تظاهرات بالینی گال نیز میتواند با سایر بیماریهای پوستی مانند اگزما یا درماتیت آتوپیک اشتباه گرفته شود، که به تأخیر در درمان و انتقال بیشتر بیماری منجر میشود. بنابراین، توسعه ابزارهای دقیق، حساس و قابلاجرا برای تشخیص قطعی گال، بهویژه در زمینه کنترل جمعی بیماری، ضروری است.
دقت تشخیص، بهویژه در برنامههای درمان جمعی (MDA) برای ریشهکنی گال، اهمیت بالایی دارد. بدون ابزار تشخیصی قابل اعتماد، ارزیابی اثربخشی درمانها، شناسایی ناقلان بدون علامت، و تعیین نقاط داغ انتقال بیماری امکانپذیر نخواهد بود. این مسئله بهویژه در شرایطی که بیماری به شکل تحتبالینی یا در مراحل اولیه بروز میکند، اهمیت دوچندان مییابد.
در این راستا، مطالعه حاضر با هدف توسعه و ارزیابی یک آزمون real-time PCR (qPCR) جدید انجام شده است که بر پایه شناسایی توالیهای تکراری DNA (repetitive DNA elements) در ژنوم کنه طراحی شده است. این آزمون تلاش دارد با افزایش حساسیت و ویژگی تشخیص، ابزاری معتبر برای شناسایی عفونت فعال فراهم کند. همچنین در این مطالعه، کارایی روشهای مختلف نمونهگیری غیرتهاجمی، از جمله سواب پوستی (FLOQ)، در مدلهای حیوانی و نمونههای انسانی بررسی شده است تا کاربرد بالینی این آزمون در شرایط واقعی نیز مورد سنجش قرار گیرد.
مواد و روشها
طراحی مطالعه
این پژوهش با رویکرد چندمرحلهای، شامل مطالعات آزمایشگاهی و میدانی، طراحی شد. در فاز اولیه، توالیهای ژنتیکی تکراری در ژنوم کنه Sarcoptes scabiei شناسایی و بر اساس آنها آزمون qPCR طراحی گردید. سپس، عملکرد این آزمون در دو بستر تجربی ارزیابی شد:
- مدل حیوانی (خوکهای آلوده به گال) برای ارزیابی کنترلشده حساسیت نمونهگیری از پوست
- نمونههای بالینی انسانی شامل بیماران مبتلا به گال تأییدشده، بیماران بدون گال، و شرکتکنندگان در برنامه غربالگری مدارس در مناطق بومی استرالیا
شناسایی و انتخاب توالیهای تکراری DNA از ژنوم کنه
برای افزایش حساسیت آزمون، ابتدا ژنوم کامل Sarcoptes scabiei var. hominis آنالیز شد و توالیهای تکراری (repetitive DNA elements) شناسایی شدند. با استفاده از نرمافزار RepeatExplorer و پایگاههای اطلاعات ژنومی، توالیهای اختصاصی با بیشترین تکرار و بدون تشابه با میزبان انسانی یا سایر میکروارگانیسمها انتخاب شدند. دو توالی به نامهای SSR5 و SSR6 با بالاترین پتانسیل تشخیصی بهعنوان اهداف اصلی برای طراحی آزمون انتخاب شدند.
طراحی پرایمرها و پروبها برای qPCR
برای هرکدام از دو توالی منتخب (SSR5 و SSR6)، مجموعهای از پرایمرها و پروبهای اختصاصی طراحی شد. پرایمرها بر اساس توالیهای کاملاً محافظتشده (conserved) در نواحی تکراری طراحی شدند و از سیستم TaqMan با پروب فلورسانت برای تشخیص استفاده شد. خصوصیات ترمودینامیک پرایمرها و پروبها (Tm، درصد GC، ساختار ثانویه) با نرمافزارهای تخصصی بهینهسازی شد. آزمونها بهگونهای طراحی شدند که در واکنشهای real-time PCR با دمای آنیلینگ ۶۰ درجه سانتیگراد کارایی بالایی داشته باشند.
روش استخراج DNA از نمونهها
الف) نمونههای آزمایشگاهی:
- کنهها از زخمهای گال در خوکهای آلوده استخراج و شستوشو داده شدند.
- نمونههای پوستی شامل خراشهای سطحی و سوابهای پوستی (FLOQ و Catch-All) تهیه شد.
ب) نمونههای انسانی:
- از نواحی فعال ضایعات در بیماران، خراش پوستی با تیغ و همچنین سواب FLOQ گرفته شد.
- در بیماران بدون ضایعه فعال، سواب از ناحیه بینانگشتی یا شکم گرفته شد.
برای استخراج DNA، از کیت QIAamp DNA Mini Kit استفاده شد و کیفیت DNA با نانودراپ و ژل الکتروفورز ارزیابی شد.
شرایط بهینه واکنش qPCR و تعیین حساسیت و ویژگی
واکنشهای qPCR با حجم نهایی ۲۰ میکرولیتر در دستگاه Applied Biosystems اجرا شد. شرایط واکنش به شرح زیر بود:
- ۹۵ درجه برای ۱۰ دقیقه (فعالسازی آنزیم)
- ۴۰ چرخه شامل ۹۵ درجه برای ۱۵ ثانیه و ۶۰ درجه برای ۱ دقیقه
حد تشخیص (limit of detection) برای هر توالی در مقایسه با DNA استاندارد کنه تعیین شد. حساسیت و ویژگی با استفاده از نمونههای مثبت و منفی قطعی محاسبه گردید. نتایج برای هر نمونه بهصورت عدد چرخه آستانه (Ct value) گزارش شد.
بررسی کارایی آزمون در بیماران مبتلا و افراد فاقد گال
مجموعهای از نمونههای انسانی در سه گروه آزمایش شدند:
- بیماران مبتلا به گال تأییدشده (n = 39)
- بیماران بدون گال اما با ضایعات پوستی دیگر (n = 10)
- کودکان بومی در برنامه غربالگری مدارس (n = 84)
آزمونهای SSR5 و SSR6 در تمام نمونهها اجرا شد. حساسیت آزمون با میکروسکوپی و تشخیص بالینی مقایسه گردید. همچنین، عملکرد دو نوع سواب در مدل حیوانی برای ارزیابی قابلیت نمونهگیری غیرتهاجمی بررسی شد.
تحلیل آماری دادهها
تحلیل دادهها با استفاده از نرمافزار GraphPad Prism انجام شد. برای مقایسه حساسیت آزمونها از آزمون مکنمار استفاده شد. مقادیر Ct میانگین و انحراف معیار برای هر گروه محاسبه شد. سطح معناداری آماری کمتر از ۰.۰۵ در نظر گرفته شد. نمودارهای ROC نیز برای ارزیابی توان تفکیکپذیری آزمون طراحی شدند.
نتایج
شناسایی و معرفی دو توالی تکراری منتخب (SSR5 و SSR6)
تحلیل بیوانفورماتیکی ژنوم Sarcoptes scabiei var. hominis منجر به شناسایی بیش از ۹۰ توالی DNA تکراری شد که میان آنها، دو توالی با بیشترین میزان کپی و ویژگی بالا نسبت به میزبان انسانی انتخاب شدند:
- SSR5 (حدود ۹۰۰ کپی در ژنوم)
- SSR6 (حدود ۷۰۰ کپی در ژنوم)
این توالیها فاقد تشابه با DNA انسانی یا سایر موجودات ساکن پوست انسان بودند، و در ارزیابی اولیه، بالاترین حساسیت را در آزمایش qPCR از خود نشان دادند.
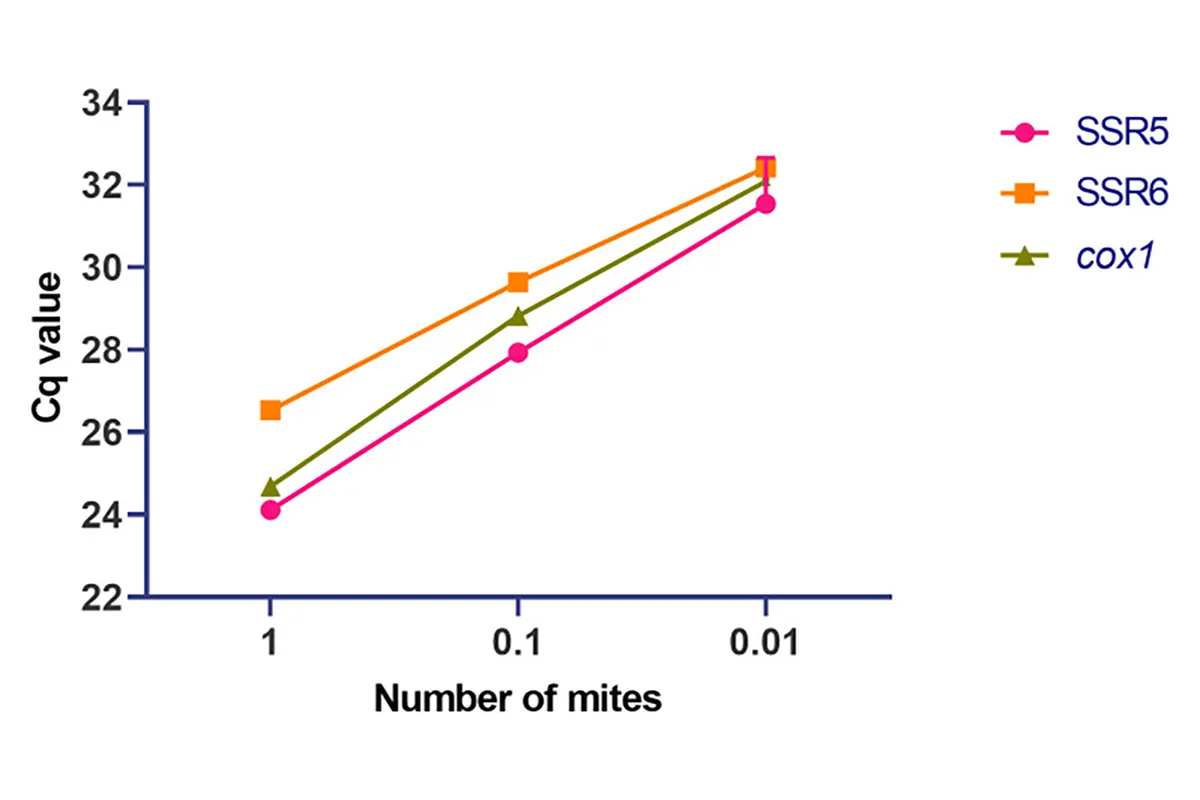
نتایج ارزیابی حساسیت و ویژگی آزمونها
در مرحله ارزیابی آزمایشگاهی، هر دو آزمون SSR5 و SSR6 قادر به شناسایی DNA کنه در غلظتهای بسیار پایین بودند.
- حد تشخیص (LoD) برای هر دو آزمون حدود ۵ تا ۱۰ نسخه ژنومی در هر واکنش بود.
- حساسیت آزمون SSR5 در نمونههای انسانی تأییدشده: ۸۹.۷٪
- حساسیت آزمون SSR6: ۸۴.۶٪
- ویژگی هر دو آزمون در افراد فاقد گال: ۱۰۰٪ (عدم واکنش متقاطع با سایر بیماریهای پوستی)
آزمون SSR5 در تمام مراحل بهعنوان تست اصلی انتخاب شد و SSR6 برای تأیید نتایج مثبت مورد استفاده قرار گرفت.
مقایسه عملکرد سواب FLOQ و Catch-All در مدل خوک
در مدل حیوانی، خوکهایی که بهطور تجربی با گال آلوده شده بودند، در روزهای مختلف پس از ابتلا با دو نوع سواب مختلف از پوست نمونهبرداری شدند. نتایج بهوضوح نشان داد که:
- سواب FLOQ در تمام مراحل بیماری حساسیت بالاتری نسبت به Catch-All داشت.
- در روز ۱۴ پس از آلودگی (مرحله خفیف)، نرخ شناسایی مثبت برای FLOQ ۷۵٪ و برای Catch-All تنها ۳۳٪ بود.
- در مراحل شدیدتر (روزهای ۲۱ و ۲۸)، هر دو روش حساسیت بالاتری داشتند، اما FLOQ همچنان بهتر عمل کرد.
این نتایج نشان دادند که استفاده از سواب FLOQ برای نمونهبرداری غیرتهاجمی از پوست، روشی مؤثر برای کاربرد میدانی و کلینیکی است.
نتایج آزمونها در نمونههای بالینی: بیماران درمانشده، درماننشده و بدون گال
در بررسی نمونههای انسانی، ۳۹ بیمار با تشخیص قطعی گال (بر اساس میکروسکوپی و بالینی) مورد آزمایش قرار گرفتند:
- در بیماران درماننشده، آزمون SSR5 در ۳۵ نفر (۸۹.۷٪) مثبت شد.
- در بیماران تحت درمان (با گذشت حداکثر ۷ روز از درمان)، آزمون مثبت در ۱۶ نفر (۴۱٪) باقی ماند.
- در گروه کنترل (۱۰ بیمار با ضایعات پوستی غیرگالی)، هیچگونه واکنش مثبتی ثبت نشد.
این نتایج نشاندهنده قدرت آزمون در شناسایی عفونت فعال است، و افت حساسیت پس از درمان میتواند نشانه کاهش بار انگل و موفقیت درمان باشد.
نتایج آزمون در کودکان بومی شرکتکننده در غربالگری مدارس
در مرحله غربالگری، از ۸۴ کودک بومی در جامعهای در شمال استرالیا، سواب FLOQ از پوست (ناحیه بین انگشتی یا شکم) تهیه شد. یافتهها نشان داد:
- در ۳ کودک با تشخیص بالینی گال، آزمون SSR5 در ۲ نفر مثبت شد.
- در ۲ کودک بدون علائم اما با تماس خانگی با بیمار مبتلا، SSR5 مثبت بود (احتمال عفونت تحتبالینی).
- در مجموع، ۵ مورد (۶٪) از نمونهها دارای نتیجه مثبت qPCR بودند، که برخی از آنها از لحاظ بالینی بدون علامت بودند.
این دادهها نشاندهنده قابلیت آزمون در شناسایی موارد خفیف یا بدون علامت هستند و نشان میدهند که میتوان از آن بهعنوان ابزار غربالگری در جوامع پرخطر استفاده کرد.
بحث
در این مطالعه، یک آزمون تشخیصی جدید بر پایه real-time PCR (qPCR) طراحی و ارزیابی شد که از توالیهای تکراری ژنوم Sarcoptes scabiei بهعنوان هدف استفاده میکرد. نتایج نشان دادند که این روش دارای حساسیت و ویژگی بالایی بوده و میتواند بهعنوان جایگزینی قابل اعتماد برای روشهای سنتی مانند میکروسکوپی مورد استفاده قرار گیرد.
مقایسه عملکرد آزمون qPCR با میکروسکوپی و روشهای قبلی
روش میکروسکوپی، علیرغم کاربرد گسترده، دارای محدودیتهای شناختهشدهای در تشخیص گال است. این روش نیازمند نمونهگیری تهاجمی (خراش پوست)، تخصص در تفسیر میکروسکوپی، و اغلب با نتایج منفی کاذب همراه است، بهویژه در موارد خفیف یا در مراحل اولیه بیماری.
در مقایسه، آزمون qPCR توسعهیافته در این مطالعه قادر بود بارهای پایین انگل را نیز شناسایی کند. حساسیت این آزمون در بیماران با تشخیص قطعی گال تا ۹۰ درصد بود، در حالی که روش میکروسکوپی در مطالعات قبلی حساسیتی بین ۴۰ تا ۶۰ درصد نشان داده بود. افزون بر این، ویژگی کامل آزمون در افراد بدون گال، آن را به ابزاری دقیق برای افتراق موارد مشکوک تبدیل میکند.
مزایای استفاده از سواب غیرتهاجمی
یکی از نوآوریهای مهم در این مطالعه، استفاده از سوابهای غیرتهاجمی برای جمعآوری نمونه از سطح پوست بود. در مدل حیوانی و نمونههای انسانی، سواب FLOQ عملکرد بالایی در انتقال DNA انگل برای تشخیص نشان داد.
مزایای اصلی این روش عبارتند از:
- سادگی اجرا، بدون نیاز به اپراتور با مهارت بالا
- راحتی برای بیمار، بهویژه در کودکان یا افرادی با پوست آسیبپذیر
- امکان استفاده در محیطهای محدود از نظر تجهیزات پزشکی
- قابلیت اجرای غربالگری جمعی بدون نیاز به روشهای تهاجمی
این ویژگیها استفاده از آزمون را در محیطهای روستایی یا در برنامههای درمان جمعی، بسیار قابلاجرا و عملی میسازد.
محدودیتهای مطالعه و دلایل تفاوت عملکرد در محیطهای مختلف
با وجود نتایج مثبت، مطالعه حاضر با برخی محدودیتها مواجه بود. اولاً، حجم نمونه نسبتاً محدود، بهویژه در گروه کنترل و کودکان بدون علامت، مانع از تعمیم کامل نتایج به جمعیتهای گستردهتر میشود. ثانیاً، عملکرد آزمون بهطور نسبی در بین جمعیتهای مختلف و در شرایط محیطی گوناگون متفاوت بود. برخی از این تفاوتها ممکن است ناشی از عوامل زیر باشد:
- کیفیت و عمق نمونهبرداری
- مرحله بالینی بیماری
- تخریب DNA در حین حملونقل یا نگهداری
- تفاوتهای ژنتیکی یا فنوتیپی در کنههای مناطق مختلف
این عوامل باید در طراحی مطالعات بعدی و اعتبارسنجیهای بیشتر مدنظر قرار گیرند.
ضرورت آموزش صحیح برای نمونهبرداری از ضایعات مناسب
همانگونه که نتایج مدل حیوانی نشان داد، محل و نحوه نمونهگیری تأثیر مستقیمی بر حساسیت آزمون دارد. ضایعات فعال، تازه و غیرپوستهدار بهترین منابع برای استخراج DNA انگل هستند. بنابراین، آموزش دقیق کارکنان بهداشتی برای شناسایی ضایعات مناسب و استفاده صحیح از سواب، شرط لازم برای اطمینان از عملکرد مطلوب این آزمون در محیطهای بالینی و غربالگری است.
در محیطهای کممنبع، طراحی بستههای آموزشی ساده، ویدئوهای عملی، و دستورالعملهای تصویری میتواند کارایی اجرای این روش را افزایش دهد.
چشمانداز استفاده از آزمون در مطالعات آینده و درمان بیماری
آزمون طراحیشده در این مطالعه، قابلیتهای متعددی برای کاربردهای آینده دارد. از جمله:
- استفاده در مطالعات اپیدمیولوژیک برای تعیین شیوع واقعی گال، حتی در موارد تحتبالینی
- پایش اثربخشی درمان در بیماران و بررسی پاسخ به دارو
- ابزار غربالگری در برنامههای درمان جمعی یا مدارس
- استفاده در محیطهای تحقیقاتی برای بررسی پویایی انتقال بیماری
با این حال، پیش از اجرای گسترده، اعتبارسنجی بیشتر در جمعیتهای متنوع، بررسی پایداری طولانیمدت نمونهها، و تحلیل هزینهاثربخشی در مقیاس عملیاتی لازم خواهد بود.
نتیجهگیری
یافتههای این مطالعه نشان میدهد که آزمون qPCR طراحیشده بر پایه توالیهای تکراری ژنومی Sarcoptes scabiei از حساسیت و ویژگی بالاتری نسبت به روشهای سنتی مانند میکروسکوپی برخوردار است. استفاده از این آزمون بهویژه در موارد مشکوک، خفیف یا تحتبالینی میتواند موجب بهبود دقت تشخیص و کاهش موارد منفی کاذب شود.
کاربرد سواب FLOQ بهعنوان روشی غیرتهاجمی، ساده و قابلپذیرش از سوی بیماران، یکی از نقاط قوت اصلی این روش تشخیصی است. عملکرد مطلوب این نوع سواب در جمعآوری DNA کنه، آن را به گزینهای مناسب برای استفاده در محیطهای بالینی، جوامع دورافتاده و برنامههای غربالگری جمعی تبدیل کرده است.
با این حال، برای اطمینان از کارایی گسترده و قابلاعتماد این آزمون، انجام مطالعات بیشتر در جمعیتهای متنوع، شرایط جغرافیایی مختلف و سناریوهای بالینی گوناگون ضروری است. همچنین بررسی هزینهاثربخشی، پایداری نمونهها، و آموزش کاربران نهایی در زمینه نمونهگیری صحیح، از دیگر اقدامات ضروری در مسیر بهکارگیری عملی این روش محسوب میشود.
در مجموع، آزمون qPCR ارائهشده در این مطالعه میتواند بهعنوان مکملی کاربردی در کنار روشهای تشخیصی موجود، گامی مهم در بهبود مدیریت بالینی گال و اجرای مؤثرتر برنامههای کنترل و ریشهکنی این بیماری در مقیاس جهانی فراهم آورد.

بدون دیدگاه