توجه: این یک مقاله علمی در مورد گال است، چنانچه نیازمند اطلاعات عمومی در مورد بیماری گال هستید، مطالعه مقاله ” گال چیست؟ ” پیشنهاد میشود.
چکیده (Abstract)
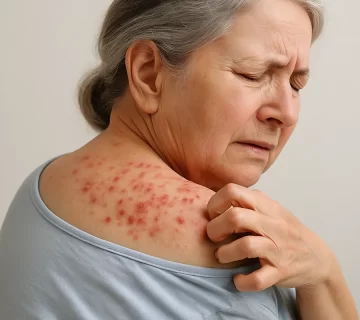
گال یک بیماری پوستی انگلی بسیار مسری است که توسط کنهای به نام Sarcoptes scabiei ایجاد میشود. این بیماری بهویژه در محیطهای تجمعی مانند خانههای سالمندان، بیمارستانها و مراکز نگهداری بیماران مزمن، شیوع بالایی دارد و یکی از دغدغههای مهم بهداشت عمومی به شمار میرود. علائم اصلی آن خارش شدید بهویژه در شب و بروز ضایعات پوستی در نواحی خاصی از بدن مانند فضاهای بین انگشتان، مچ دست، زیر بغل و ناحیه تناسلی است. با این حال، تظاهرات بالینی گال بهویژه در سالمندان یا افراد با بیماریهای زمینهای ممکن است غیرمعمول بوده و منجر به تأخیر در تشخیص شود.
روش رایج تشخیص این بیماری، بررسی میکروسکوپی خراشهای پوستی است، اما حساسیت این روش در شرایط مختلف پایین بوده و موارد زیادی از بیماران به اشتباه منفی گزارش میشوند. به همین دلیل، نیاز به روشهای تشخیصی دقیقتر و حساستر در تشخیص گال احساس میشود.
در این مطالعه، ارزش تشخیصی روش واکنش زنجیرهای پلیمراز (PCR) برای شناسایی مستقیم DNA انگل Sarcoptes scabiei از نمونههای خراش پوستی بیماران مشکوک به گال بررسی شد. این پژوهش بر روی ۴۷ شرکتکننده شامل بیماران با علائم مشکوک، افراد با بیماریهای پوستی غیرمرتبط و داوطلبان سالم در یک بیمارستان دانشگاهی در سئول، کره جنوبی انجام شد. بیماران بر اساس معیارهای بینالمللی تشخیص گال (IACS) به گروههای “تأیید شده”، “بالینی”، “مشکوک” و “فاقد گال” طبقهبندی شدند. همزمان نمونهگیری برای آزمایش میکروسکوپی و PCR انجام گرفت.
نتایج نشان داد حساسیت آزمایش میکروسکوپی در گروه تأیید شده ۱۰۰٪ بود، اما با کاهش قطعیت بالینی، این عدد به ۷۳٪ کاهش یافت. در مقابل، حساسیت PCR در همان گروهها به ترتیب ۸۶٪، ۸۳٪ و ۸۰٪ بود که کاهش کمتری نشان داد. همچنین، PCR در تمامی افراد سالم یا دارای بیماری غیرمرتبط، نتیجه منفی داشت که نشاندهنده ویژگی ۱۰۰٪ این روش است.
این مطالعه نشان داد که PCR میتواند به عنوان یک روش مکمل تشخیصی، دقت تشخیص گال را در بیماران مشکوک به ویژه در مواردی که تست میکروسکوپی منفی است، بهبود بخشد. استفاده از این تکنیک میتواند به کاهش خطاهای تشخیصی، جلوگیری از شیوع بیشتر بیماری و بهبود درمان کمک نماید.
مقدمه (Introduction)
تعریف بیماری گال و عامل بیماریزا:
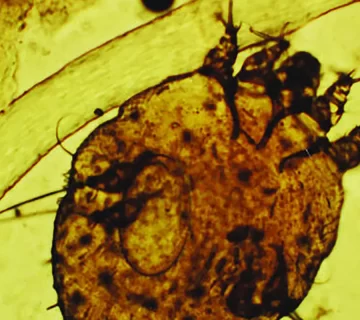
گال یک بیماری پوستی انگلی است که توسط کنه میکروسکوپی Sarcoptes scabiei ایجاد میشود. این انگل با حفر تونل در لایههای سطحی پوست، تخمگذاری میکند و منجر به واکنش التهابی شدید و خارش مزمن در فرد میزبان میشود. خارش معمولاً در شب تشدید میشود و همراه با بثورات پوستی به شکل پاپول، ندول، وزیکول و ضایعات خراشیده است. نواحی شایع درگیری شامل فضای بین انگشتان، مچ دست، آرنج، زیر بغل، شکم، باسن و ناحیه تناسلی میباشد.
شیوع و اهمیت در سالمندان و مراکز نگهداری:
گال بهویژه در محیطهای تجمعی مانند خانههای سالمندان، مراکز نگهداری بیماران مزمن، و بیمارستانها بهعنوان یک چالش مهم بهداشتی شناخته میشود. انتقال آن عمدتاً از طریق تماس نزدیک و مداوم پوستی اتفاق میافتد. در افراد سالمند و ناتوان، که ممکن است در ابراز علائم ناتوان باشند یا ضایعات پوستی غیرمعمولی نشان دهند، تشخیص بهموقع بیماری بسیار دشوار است. شیوع گال در چنین محیطهایی میتواند به بروز اپیدمیهای خطرناک منجر شود.
مشکلات روشهای تشخیصی رایج (میکروسکوپی، درموسکوپی):
روش استاندارد تشخیص گال بررسی میکروسکوپی خراش پوست است که در آن بهدنبال مشاهده کنه، تخم یا مدفوع انگل میگردند. با وجود آنکه این روش بهعنوان مرجع تشخیصی بهکار میرود، اما حساسیت پایینی دارد و بسیاری از موارد، بهویژه در مراحل ابتدایی یا در صورت نمونهگیری نادرست، شناسایی نمیشوند. همچنین، درموسکوپی به تجربه بالای پزشک وابسته است و ممکن است در شرایط خاص از دقت کافی برخوردار نباشد.
مزیتهای احتمالی روش PCR:
روش واکنش زنجیرهای پلیمراز (PCR) یک ابزار مولکولی پیشرفته است که امکان شناسایی مستقیم DNA انگل را در نمونههای خراش پوست فراهم میسازد. این روش نسبت به روشهای سنتی از حساسیت و ویژگی بالاتری برخوردار است و میتواند حتی در مواردی که بار انگل پایین است یا نمونهبرداری ناقص انجام شده، DNA انگل را شناسایی کند. در سالهای اخیر، با پیشرفت تکنولوژی و طراحی پرایمرهای اختصاصی، امکان شناسایی ژنهای خاص مانند cox1 در Sarcoptes scabiei فراهم شده است.
هدف از این مطالعه:
مطالعه حاضر با هدف بررسی ارزش تشخیصی PCR در شناسایی DNA انگل گال در بیماران مشکوک، انجام شده است. در این پژوهش، حساسیت و ویژگی روش PCR با روش میکروسکوپی مقایسه شد و شرکتکنندگان بر اساس معیارهای بینالمللی IACS (International Alliance for the Control of Scabies) طبقهبندی شدند. هدف اصلی، ارزیابی عملکرد تشخیصی PCR بهعنوان یک روش مکمل یا جایگزین در بیماران با علائم گال، بهویژه در شرایطی است که تشخیص بهروشهای سنتی دشوار است.
مرور منابع (Literature Review)
مطالعات پیشین در مورد PCR در تشخیص گال
در دهههای اخیر، با افزایش آگاهی نسبت به محدودیتهای روشهای سنتی تشخیص گال، توجه پژوهشگران به استفاده از تکنیکهای مولکولی از جمله واکنش زنجیرهای پلیمراز (PCR) معطوف شده است. مطالعات اولیه مانند مطالعه Bezold et al. (2001) برای نخستین بار نشان داد که PCR میتواند DNA انگل Sarcoptes scabiei را در نمونههای خراش پوستی بیماران مبتلا به گال شناسایی کند، حتی در مواردی که آزمایش میکروسکوپی منفی بوده است. پس از آن، پژوهشهایی مانند Fukuyama و همکاران (2010)، Wong و همکاران (2015) و Hahm و همکاران (2018) روشهای مختلف PCR از جمله PCR معمولی، real-time PCR و nested PCR را برای شناسایی انگل گال ارزیابی کردند.
نتایج ضد و نقیض در حساسیت و ویژگی تستها
با وجود پیشرفتهای حاصلشده، نتایج مطالعات مختلف در خصوص حساسیت و ویژگی PCR در تشخیص گال همچنان متناقض باقی مانده است. برخی گزارشها، حساسیت PCR را کمتر از ۶۰٪ گزارش کردهاند، در حالی که برخی دیگر از حساسیتی بیش از ۸۰٪ حکایت دارند. علت این تفاوتها را میتوان در عوامل متعددی جستوجو کرد، از جمله نوع نمونهگیری، مرحله بیماری، طراحی پرایمرها، تعداد انگل در ضایعه، و حتی تفاوتهای ژنتیکی میان جمعیتهای انگل در مناطق مختلف جغرافیایی. افزون بر این، در بسیاری از این مطالعات، معیار مشخص و استانداردی برای تعریف موارد مثبت و منفی گال وجود نداشته و در اغلب موارد از تشخیص بالینی یا میکروسکوپی بهعنوان معیار مرجع استفاده شده است، که خود دارای خطای تشخیصی است.
معرفی معیارهای IACS و اهمیت آنها
در سال ۲۰۱۸، ائتلاف بینالمللی کنترل گال (IACS)، با هدف بهکارگیری یک نظام طبقهبندی استاندارد و جهانی برای تشخیص گال، اقدام به تدوین مجموعهای از معیارهای بالینی و آزمایشگاهی کرد. این معیارها بیماران را در سه سطح تشخیص شامل “تأیید شده”، “بالینی” و “مشکوک” دستهبندی میکنند و بر اساس وجود ضایعات تیپیک، تاریخچه تماس نزدیک، خارش شبانه، و شواهد آزمایشگاهی مانند مشاهده انگل، تخم یا مدفوع در زیر میکروسکوپ طبقهبندی میشوند. استفاده از این معیارها در طراحی مطالعات تشخیصی میتواند به دقت و قابلیت تکرارپذیری نتایج کمک کند و از تداخل خطای تشخیص بالینی جلوگیری نماید.
بررسی ژنتیک انگل گال و اهمیت تشخیص مولکولی دقیق
مطالعات اخیر بر ژنتیک انگل Sarcoptes scabiei نشان میدهند که این کنه ممکن است در میان انسانها و سایر میزبانان دارای تفاوتهای ژنتیکی قابل توجهی باشد. مطالعهای در سال ۲۰۱۵ توسط Andriantsoanirina و همکاران، نشان داد که انگلهای گال انسانی در سه دودمان ژنتیکی اصلی طبقهبندی میشوند، که ممکن است حتی در یک منطقه جغرافیایی مشابه حضور داشته باشند. این تنوع ژنتیکی میتواند بر موفقیت روشهای مولکولی مانند PCR اثرگذار باشد، بهویژه اگر پرایمرها بهدرستی طراحی نشده باشند. در نتیجه، طراحی هدفمند پرایمرهایی که نواحی محافظتشدهای مانند ژن cox1 را هدف قرار میدهند، از اهمیت بالایی برخوردار است. چنین طراحیای میتواند تضمین کند که تست PCR قادر به شناسایی سویههای متنوع انگل بوده و از بروز نتایج منفی کاذب جلوگیری شود.
روششناسی (Materials and Methods)
شرح شرکتکنندگان، معیارهای ورود و خروج
این مطالعه بهصورت مقطعی و آیندهنگر، در یک مرکز درمانی دانشگاهی با ظرفیت ۲۷۰۰ تخت در شهر سئول، کره جنوبی، از دسامبر ۲۰۱۷ تا اکتبر ۲۰۱۸ انجام شد. جمعاً ۴۷ نفر در مطالعه شرکت داشتند که شامل ۳۳ بیمار با علائم مشکوک به گال، ۱۰ بیمار با بیماریهای پوستی غیرمرتبط (مانند اونیکومیکوز) و ۴ داوطلب سالم بدون هرگونه علائم یا بیماری پوستی بودند.
معیارهای ورود شامل بیماران بزرگسال با ضایعات پوستی مشکوک به گال، افرادی با سابقه خارش مزمن، یا تماس نزدیک با فردی مبتلا به گال بودند. معیارهای خروج نیز شامل وجود بیماریهای پوستی تاییدشده غیرگالی، استفاده اخیر از درمانهای ضدانگل، یا عدم تمایل به شرکت در مطالعه بود. تمامی شرکتکنندگان پیش از ورود به مطالعه، فرم رضایتنامه کتبی را امضا کردند و مطالعه مورد تأیید کمیته اخلاقی مرکز درمانی (شماره پرونده: 2018–0640) قرار گرفت.
نحوه نمونهگیری و استخراج DNA
برای انجام نمونهگیری، ابتدا یک متخصص پوست با تجربه، ضایعات مشکوک را روی پوست بیماران شناسایی و علامتگذاری کرد. سپس، از هر بیمار خراشهای پوستی (skin scraping) از حدود ۱۰ تا ۱۵ نقطه از ضایعات انجام شد. این نمونهها توسط پرستاری مجرب گرفته شد تا کیفیت نمونه حفظ شود. نمونهبرداری همزمان برای بررسی میکروسکوپی و آزمایش PCR انجام شد.
نمونههای جمعآوریشده در دمای ۸۰- درجه سلسیوس نگهداری شدند تا زمان استخراج DNA. برای استخراج DNA، از کیت QIAamp DNA Mini (Qiagen, Germany) با اصلاحات جزئی استفاده شد. ابتدا نمونهها با دایتیاچتی (DTT) و پروتئیناز K در دمای ۵۶ درجه به مدت ۲ ساعت انکوبه شدند، سپس مراحل تخریب سلولی و شستشو طبق پروتکل کیت دنبال شد. در نهایت DNA خالص در ۱۰۰ میکرولیتر بافر AE حل و برای PCR استفاده گردید.
طراحی پرایمرها و مشخصات تکنیکی PCR
برای شناسایی مولکولی Sarcoptes scabiei، پرایمرها و پروبهای اختصاصی برای ژن cytochrome c oxidase subunit 1 (cox1) طراحی شدند که ناحیهای پایدار و بدون همپوشانی ژنتیکی با سایر انگلهای پوستی دارند. توالی پرایمرها بهشرح زیر است:
- cox1F (Forward): 5’-ATGATTTCTATTGCAACTTTAGG-3’
- cox1R (Reverse): 5’-TTGCTCAATACATAGAGGGGTTA-3’
- پروب (TaqMan): 5’-FAM-AATATTAGGGGGAAAATTAGATTTTAACCC-BHQ1-3’
علاوه بر این، یک کنترل داخلی با پرایمرهای ACBT نیز طراحی شد تا کیفیت واکنش تایید گردد. ویژگی اختصاصی این پرایمرها از طریق BLAST در پایگاه NCBI بررسی شد و هیچ همپوشانی با DNA گونههای دیگری نظیر Demodex, Dermatophagoides, یا Cheyletus مشاهده نشد.
واکنش PCR با استفاده از دستگاه Real-Time PCR مدل LightCycler 96 (Roche) و کیت FastStart Essential DNA Probe Master انجام شد. شرایط واکنش شامل:
- مرحله پیشگرمایش در ۹۵ درجه برای ۵ دقیقه
- ۴۵ سیکل دمایی شامل: ۹۵ درجه برای ۵ ثانیه و ۵۶ درجه برای ۳۰ ثانیه
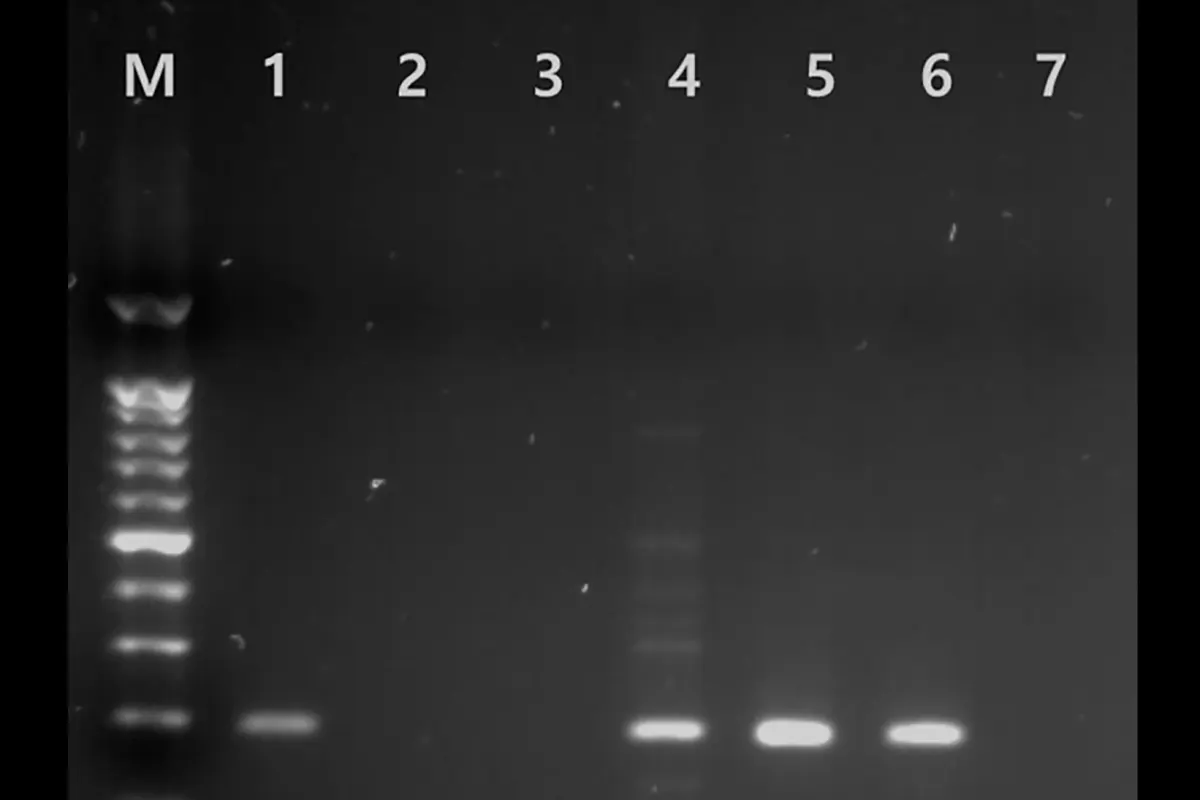
در هر آزمایش، یک نمونه مثبت و یک نمونه منفی بهعنوان کنترل استفاده شد. محصول PCR با روش الکتروفورز بررسی و سپس با استفاده از QIAquick Gel Extraction Kit خالصسازی گردید. در نهایت، توالییابی DNA برای تایید صحت هدف انجام شد.
نحوه دستهبندی بیماران بر اساس معیار IACS
تمامی بیماران بر اساس معیارهای ائتلاف بینالمللی کنترل گال (IACS) که در سال ۲۰۱۸ منتشر شدهاند، طبقهبندی شدند. این دستهبندی شامل موارد زیر بود:
- گال تأییدشده: مشاهده انگل، تخم یا مدفوع در نمونه میکروسکوپی
- گال بالینی: وجود ضایعات تیپیک بههمراه دو ویژگی تاریخچهای مانند خارش شبانه و تماس نزدیک
- گال مشکوک: ضایعات تیپیک با تنها یک ویژگی تاریخچهای، یا ضایعات غیرتیپیک با دو ویژگی تاریخچهای
- فاقد گال: بیمارانی که در هیچیک از دستههای فوق قرار نگرفتند
در این مطالعه، ابزارهایی مانند درموسکوپ مورد استفاده قرار نگرفت تا از مداخله در نتایج پیشگیری شود.
تحلیل آماری مورد استفاده
برای تحلیل دادهها، از نرمافزار SPSS نسخه ۲۴ (IBM, Armonk, NY, USA) استفاده شد. حساسیت و ویژگی روشهای تشخیصی (PCR و میکروسکوپی) با استفاده از فاصله اطمینان ۹۵٪ (95% CI) و آزمون دقیق کلپر-پیرسون محاسبه شدند. برای بررسی اختلاف معناداری آماری در بین گروههای مختلف (تأییدشده، بالینی، مشکوک)، از آزمون linear-by-linear association استفاده شد. همچنین، برای مقایسه حساسیت PCR با میکروسکوپ در سطوح مختلف قطعیت بالینی از آزمونهای مقایسهای (مانند آزمون دقیق فیشر) استفاده گردید و p-value کمتر از 0.05 معنادار در نظر گرفته شد.
یافتهها (Results)
جمعیتشناسی بیماران (سن، جنس، شرایط زمینهای)
از مجموع ۴۷ شرکتکننده در این مطالعه، ۳۳ نفر دارای علائم مشکوک به گال بودند و ۱۴ نفر (۱۰ بیمار با اونیکومیکوز و ۴ داوطلب سالم) بهعنوان گروه کنترل بدون گال در نظر گرفته شدند. در بین ۳۳ بیمار مشکوک، ۲۲ نفر بهعنوان “گال تأییدشده”، ۲ نفر “گال بالینی”، ۶ نفر “گال مشکوک” و ۳ نفر بهعنوان “فاقد گال” طبقهبندی شدند. گروه کنترل شامل همین ۳ نفر بهعلاوه ۱۰ بیمار با بیماری غیرگالی و ۴ فرد سالم بود.
میانگین سنی بیماران مبتلا به گال (تأییدشده، بالینی، مشکوک) برابر با ۶۰ سال (±۱۷ سال، فاصله اطمینان ۵۴ تا ۶۷ سال) بود. از این تعداد، ۵۷٪ مرد و ۴۳٪ زن بودند. سوابق پزشکی نشان داد که ۴۳٪ از بیماران سابقه بستری در بیمارستان و ۳۳٪ نیز سابقه تماس با بیمار یا همراه بیمار در مراکز درمانی را داشتند. همچنین ۲۳٪ از بیماران به علت بیماریهای زمینهای ناتوانی حرکتی داشته و بستری بلندمدت در منزل یا مراکز درمانی داشتهاند.
محلهای شایع ضایعات پوستی
در میان بیماران مبتلا به گال، شایعترین تظاهر پوستی، پاپولها (در ۷۷٪ موارد) بودند. پس از آن ندول (۷٪)، ضایعات خراشیده (۷٪) و بثورات اگزمایی گزارش شدند. شایعترین نواحی درگیر بدن شامل:
- تنه: ۹۰٪
- اندامها (دست و پا): ۷۳٪
- ناحیه تناسلی: ۲۳٪
- دستها (بهطور خاص): ۴۳٪
هیچ موردی از “گال دلمهای (crusted scabies)” در بین بیماران گزارش نشد.
درصد نتایج مثبت PCR و میکروسکوپی در گروههای مختلف
در جدول زیر نتایج مقایسهای PCR و میکروسکوپی در سطوح مختلف تشخیص بر اساس معیار IACS نشان داده شده است:
| گروه تشخیصی | تعداد کل | PCR مثبت | PCR حساسیت (٪) | میکروسکوپ مثبت | میکروسکوپ حساسیت (٪) |
|---|---|---|---|---|---|
| گال تأییدشده | 22 | 19 | 86٪ (CI 65–97) | 22 | 100٪ (CI 85–100) |
| تأییدشده + بالینی | 24 | 20 | 83٪ (CI 63–95) | 22 | 92٪ (CI 73–99) |
| تأییدشده + بالینی + مشکوک | 30 | 24 | 80٪ (CI 61–92) | 22 | 73٪ (CI 54–88) |
| گروه کنترل (بدون گال) | 17 | 0 | ویژگی: 100٪ (CI 80–100) | 0 | ویژگی: 100٪ (CI 80–100) |
از میان ۳۰ بیمار مبتلا به گال، ۵ نفر (۱۷٪) دارای تست میکروسکوپی منفی ولی PCR مثبت بودند که شامل یک مورد بالینی و چهار مورد مشکوک به گال بودند. در مقابل، ۳ بیمار (۱۰٪) با میکروسکوپ مثبت ولی PCR منفی شناسایی شدند. این موارد احتمالاً به دلیل تنوع ژنتیکی انگل یا خطای نمونهگیری رخ دادهاند.
مقایسه حساسیتها و ویژگیها با جداول
نتایج نشان داد که کاهش سطح قطعیت تشخیصی (از تأییدشده به مشکوک) منجر به افت معنادار حساسیت در روش میکروسکوپی شد (p = 0.006)، در حالی که کاهش مشابه در حساسیت PCR از نظر آماری معنادار نبود (p = 0.59). مقایسه بین PCR و میکروسکوپ در هر گروه نیز تفاوت معناداری از نظر آماری نداشت (برای مثال در گروه کامل: p = 0.54).
نمودارهای آمپلیفیکیشن و کالیبراسیون
نمودارهای مربوط به واکنش Real-Time PCR نشان دادند که آزمون توانایی شناسایی DNA انگل را حتی در غلظتهای پایین دارد. نمودار کالیبراسیون (استاندارد) از رقتهای دهبرابری پلاسمید حاوی ژن cox1 تهیه شد که نشاندهنده رابطه خطی بین مقدار DNA و مقدار Ct (Cycle threshold) بود. تحلیل حساسیت عملکرد نشان داد که آزمون PCR توانایی شناسایی تا حداقل یک کپی ژن در هر واکنش را دارد. منحنیهای آمپلیفیکیشن در نمودارهای S شکل، دقت و کارایی آزمون را تایید میکنند.
بحث و بررسی (Discussion)
تفسیر نتایج: چرا PCR حساستر از میکروسکوپ است
نتایج این مطالعه نشان داد که حساسیت روش واکنش زنجیرهای پلیمراز (PCR) در تشخیص گال، بهویژه در بیماران با علائم غیراختصاصی یا سطح پایین آلودگی، بالاتر از روش سنتی میکروسکوپی است. این تفاوت عملکرد را میتوان به ویژگی ذاتی PCR در شناسایی مقادیر بسیار اندک DNA انگل نسبت داد، در حالی که میکروسکوپ نیازمند مشاهده مستقیم انگل یا اجزای آن در نمونه است. در مواردی که تعداد انگل کم است، یا تکنیک نمونهگیری ضعیف باشد، احتمال عدم مشاهده مستقیم در میکروسکوپ بسیار بالاست. در مقابل، PCR قادر است حتی با حضور تعداد اندک انگل، DNA آن را تشخیص دهد.
بررسی علت نتایج منفی کاذب و مثبت کاذب
در مطالعه حاضر، در ۵ بیمار، نتیجه PCR مثبت و میکروسکوپی منفی بود. این موارد میتوانند بهعنوان «منفی کاذب میکروسکوپ» یا «مثبت واقعی PCR» در نظر گرفته شوند، بهویژه با توجه به ویژگی ۱۰۰٪ PCR در گروه کنترل. بالعکس، در ۳ بیمار، نتیجه PCR منفی و میکروسکوپ مثبت بود. علل احتمالی این ناهماهنگیها عبارتند از:
- تجزیه DNA انگل در نمونه، در اثر نگهداری یا استخراج نامناسب
- حضور سویههایی با جهش در ناحیه هدف پرایمرهای PCR (مانند ژن cox1)
- آلودگی نمونه یا خطای انسانی در فرآیند انجام آزمایش
- اشتباه در تفسیر میکروسکوپی (مثلاً اشتباه در شناسایی ذرات غیرانگلی بهعنوان تخم یا مدفوع انگل)
ارتباط با یافتههای مطالعات پیشین
یافتههای این پژوهش با مطالعات قبلی مانند پژوهشهای Wong et al. (2015) و Fukuyama et al. (2010) همسو است که نشان دادند PCR بهویژه در بیماران مشکوک به گال با تست منفی میکروسکوپی، میتواند ابزار تشخیصی مؤثری باشد. با این حال، برخی از مطالعات قبلی حساسیت پایینتری را برای PCR گزارش کردهاند، که ممکن است به تفاوت در طراحی پرایمرها، روش استخراج DNA، یا جمعیت هدف (کودکان، سالمندان، افراد با ایمنی ضعیف) مرتبط باشد.
تأثیر تنوع ژنتیکی انگل در نتیجه تستها
یکی از عوامل مهم در بروز نتایج منفی کاذب در PCR، تنوع ژنتیکی میان سویههای مختلف Sarcoptes scabiei است. مطالعهای در سال ۲۰۱۵ نشان داد که انگلهای انسانی در سه دودمان ژنتیکی مجزا طبقهبندی میشوند. اگر پرایمرهای PCR بر اساس توالی یک سویه خاص طراحی شده باشند، ممکن است در شناسایی سویههای دیگر ناکارآمد باشند. بنابراین، انتخاب نواحی محافظتشده ژنی مانند cox1، که در بین سویهها نسبتاً پایدار است، از اهمیت بالایی برخوردار است.
مزایا و محدودیتهای مطالعه
از مزایای این مطالعه میتوان به موارد زیر اشاره کرد:
- استفاده از معیارهای استاندارد IACS برای طبقهبندی بیماران
- اجرای همزمان میکروسکوپی و PCR بر روی نمونههای یکسان
- طراحی پرایمرهای اختصاصی با بررسی دقیق BLAST
اما این پژوهش محدودیتهایی نیز دارد:
- حجم نمونه نسبتاً محدود (۴۷ شرکتکننده)
- وابستگی کیفیت نمونهگیری به تجربه پرسنل
- عدم استفاده از ابزارهای تصویربرداری مکمل مانند درموسکوپ
- محدود بودن مطالعه به یک مرکز درمانی خاص در کره جنوبی
کاربرد بالینی PCR بهعنوان روش مکمل تشخیص
با توجه به نتایج بهدستآمده، PCR میتواند بهعنوان یک روش مکمل در کنار روشهای سنتی تشخیص گال بهکار رود، بهویژه در مواردی که علائم غیراختصاصی بوده و تست میکروسکوپی منفی است. استفاده از PCR میتواند در کنترل اپیدمیها در مراکز نگهداری، خانههای سالمندان و بیمارستانها نقش مؤثری ایفا کند و از تأخیر در تشخیص جلوگیری نماید.
پیشنهادات برای مطالعات آینده
برای تعمیمپذیری نتایج این پژوهش، مطالعات آینده میتوانند به موارد زیر بپردازند:
- افزایش تعداد نمونهها و مراکز درگیر در مطالعه
- بررسی عملکرد PCR در جمعیتهای خاص مانند کودکان، بیماران سرطانی یا ایمنوتضعیف
- توسعه PCR چندگانه (Multiplex) برای شناسایی همزمان سایر بیماریهای پوستی
- تحلیل کامل ژنتیک انگل در نواحی مختلف جغرافیایی و بررسی تأثیر آن بر حساسیت PCR
- ارزیابی اقتصادی و هزینه-فایده استفاده از PCR در مقایسه با میکروسکوپی در مراکز درمانی
نتیجهگیری (Conclusion)
نتایج این مطالعه نشان داد که روش واکنش زنجیرهای پلیمراز (PCR) برای شناسایی DNA انگل Sarcoptes scabiei از خراشهای پوستی، ابزاری دقیق، حساس و قابلاطمینان در تشخیص گال به شمار میرود. در مقایسه با روش سنتی میکروسکوپی که نیازمند مشاهده مستقیم انگل یا اجزای آن است و از حساسیت محدودی برخوردار است، PCR قادر است حتی در مواردی با بار کم انگل نیز بهطور مؤثر بیماری را شناسایی کند. این ویژگی، اهمیت بالینی قابلتوجهی دارد، بهویژه در بیماران دارای علائم غیراختصاصی یا در مراحل ابتدایی بیماری.
با توجه به یافتههای پژوهش، توصیه میشود که در بیماران مشکوک به گال، بهویژه زمانی که نتایج میکروسکوپی منفی است اما شواهد بالینی همچنان بیماری را محتمل نشان میدهند، از تست PCR بهعنوان روش مکمل تشخیصی استفاده شود. این اقدام میتواند به تشخیص سریعتر، پیشگیری از گسترش بیماری در مراکز تجمعی، و شروع بهموقع درمان کمک کند.
با این حال، بهمنظور ارزیابی دقیقتر عملکرد PCR در گروههای جمعیتی متنوع و شرایط بالینی مختلف، انجام مطالعات آیندهنگر گستردهتر در مراکز درمانی متعدد و در مقیاس بزرگتر ضروری است. همچنین، بررسی اثربخشی این روش در سطوح مختلف سیستمهای بهداشتی و تحلیل هزینه-فایده آن در مقایسه با روشهای موجود میتواند به توسعه یک راهکار جامع برای تشخیص سریع و مؤثر گال کمک شایانی نماید.

بدون دیدگاه