توجه: این یک مقاله علمی در مورد گال است، چنانچه نیازمند اطلاعات عمومی در مورد بیماری گال هستید، مطالعه مقاله ” گال چیست؟ ” پیشنهاد میشود.
مقدمه
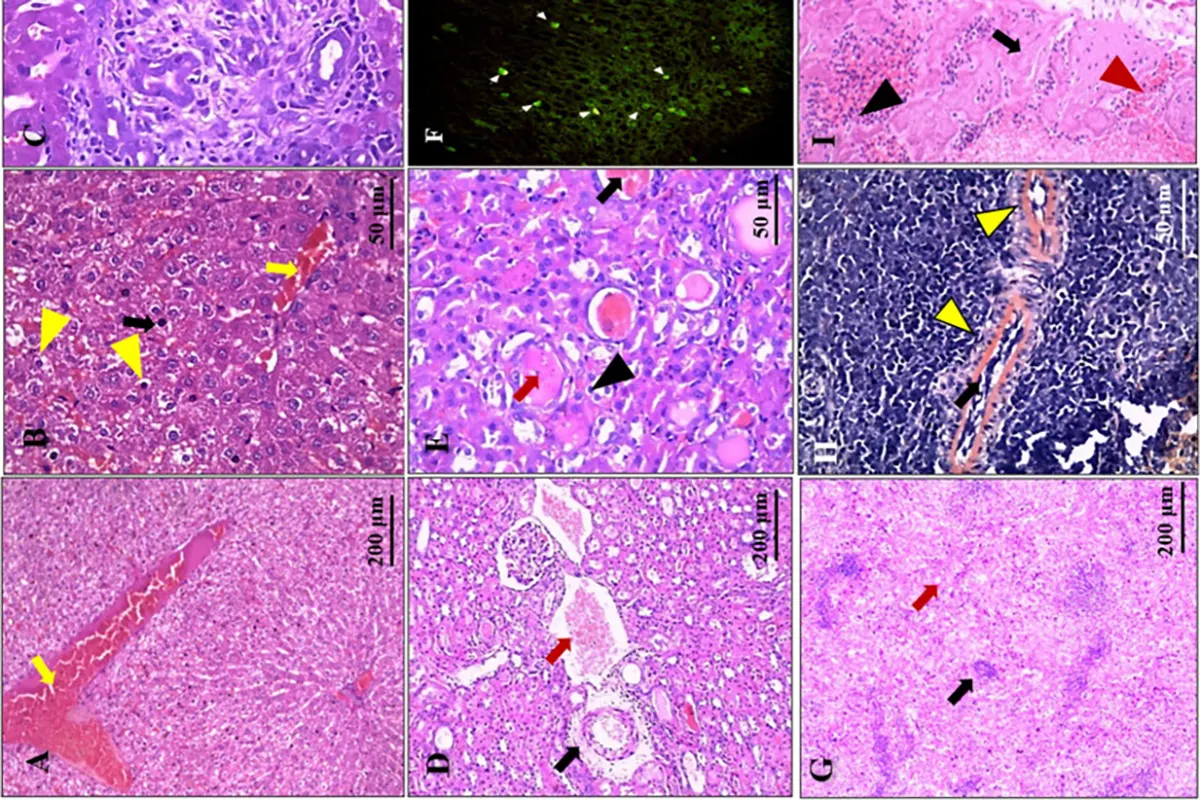
گال نروژی، که با نام گال پوستهدار یا Crusted Scabies نیز شناخته میشود، یک شکل شدید، پر بار انگلی و بهشدت مسری از بیماری گال است که در اثر آلودگی گسترده با کنه Sarcoptes scabiei var. hominis ایجاد میشود. برخلاف گال معمولی که معمولاً با خارش موضعی و تعداد اندکی از کنه همراه است، گال نروژی با تکثیر بسیار زیاد کنه، هیپرکراتوز شدید، و ضایعات گسترده پوستی تظاهر مییابد. این شکل از بیماری معمولاً در افراد با ضعف ایمنی، سالمندان، مبتلایان به اختلالات عصبی یا روانی، و بیماران بستری در مراکز مراقبتی بلندمدت دیده میشود. بهدلیل بار بالای انگلی و احتمال آلودگی وسیع سطوح، گال نروژی یکی از پرخطرترین منابع انتقال بیماری در جوامع بسته و پرجمعیت محسوب میشود.
در برنامههای کنترل جمعی بیماری گال، بهویژه در کشورهایی که درمان جمعی یا Mass Drug Administration (MDA) با ایورمکتین برای ریشهکنی بیماری اجرا میشود، وجود حتی یک مورد از گال نروژی میتواند منجر به شکست گسترده برنامه گردد. بیماران مبتلا به گال نروژی اغلب بهعنوان «ناقلان خاموش» عمل میکنند؛ زیرا بهدلیل نقص ایمنی یا عدم توانایی در بیان علائم، بهموقع شناسایی نمیشوند و در نتیجه بهمدت طولانی منبع آلودگی باقی میمانند. از سوی دیگر، پاسخ درمانی در این بیماران ضعیفتر بوده و نیازمند پروتکلهای درمانی تقویتشده، ایزولاسیون کامل و پیگیری مداوم است. به همین دلیل، گال نروژی نهتنها یک بیماری فردی، بلکه یک تهدید جدی برای سلامت عمومی و موفقیت برنامههای منطقهای مهار گال محسوب میشود.
با وجود این اهمیت بالینی و اپیدمیولوژیک، دادههای جمعیتمحور در مورد اپیدمیولوژی، ویژگیهای بالینی، الگوهای درمانی، میزان عود، و پیامدهای مرگومیر ناشی از گال نروژی بسیار محدود است. بیشتر مطالعات موجود به گزارشهای موردی یا بررسیهای توصیفی محدود میشوند که امکان ارائه یک تصویر جامع از ابعاد این بیماری را فراهم نمیکنند.
مطالعه حاضر با هدف پر کردن این شکاف اطلاعاتی و ارائه تحلیل جامع از موارد گال نروژی در یک جمعیت با شیوع بالا طراحی شده است. تمرکز بر ویژگیهای دموگرافیک، شدت بیماری، پاسخ به درمان، عوامل مستعدکننده عود، و مرگومیر، نهتنها درک بهتری از الگوهای بالینی گال نروژی فراهم میکند، بلکه میتواند مبنای تدوین راهبردهای مؤثرتر برای شناسایی، درمان، پیگیری و کنترل این بیماری در سطح منطقهای و ملی باشد.
در شرایطی که بسیاری از کشورها در حال اجرای یا توسعه برنامههای درمان جمعی برای گال هستند، پرداختن دقیق و علمی به گال نروژی و نقش آن در پویایی انتقال بیماری، ضرورتی انکارناپذیر در مسیر موفقیت این برنامهها تلقی میشود.
روششناسی تحقیق
نوع مطالعه
این پژوهش یک مطالعه گذشتهنگر با طراحی مشاهدهای و تحلیلی بود که بهصورت طولی انجام شد. هدف از مطالعه، بررسی ویژگیهای بالینی، شدت بیماری، الگوهای درمان، میزان عود و پیامدهای مرگومیر در بیماران مبتلا به گال نروژی طی یک بازه زمانی چندساله بود. مطالعه بر اساس دادههای ثبتشده بیماران در مرکز کنترل بیماریهای عفونی منطقهای در شمال استرالیا صورت گرفت.
جامعه آماری و معیارهای ورود/خروج
جامعه مورد بررسی شامل کلیه بیمارانی بود که در فاصله سالهای ۲۰۰۲ تا ۲۰۱۸ در بیمارستان رویال داروین و مراکز وابسته به آن تحت پیگیری قرار گرفته و بر اساس معیارهای بالینی و میکروسکوپی، تشخیص قطعی گال نروژی برای آنها ثبت شده بود.
معیارهای ورود به مطالعه شامل موارد زیر بود:
- وجود شواهد بالینی و/یا هیستوپاتولوژیک مؤید گال نروژی
- ثبت پرونده پزشکی کامل شامل مشخصات دموگرافیک، یافتههای بالینی، درمان و پیگیری
معیارهای خروج شامل:
- نبود دادههای کامل درمانی یا تشخیصی
- شک به تشخیص یا موارد غیرقطعی
- عدم امکان پیگیری حداقل سه ماه پس از درمان
در مجموع، 85 بیمار با تشخیص قطعی گال نروژی وارد تحلیل نهایی شدند.
ابزار گردآوری اطلاعات و روش تحلیل آماری
اطلاعات مورد نیاز از طریق مرور پروندههای پزشکی الکترونیک و کاغذی جمعآوری شد. دادهها شامل متغیرهای دموگرافیک (سن، جنس، قومیت، محل اقامت)، ویژگیهای بالینی (محل و شدت ضایعات، علائم سیستمیک، نمره شدت بیماری)، وضعیت ایمنی بیمار، بیماریهای زمینهای، رژیم درمانی (نوع دارو، تعداد دوز، درمان موضعی/خوراکی)، پاسخ به درمان، مدت بستری، وقوع عوارض و مرگومیر بود.
تحلیل آماری با استفاده از نرمافزار Stata نسخه ۱۵ انجام شد. از آمار توصیفی برای نمایش میانگین، میانه، انحراف معیار و درصد استفاده شد. برای بررسی ارتباط میان متغیرها از آزمونهای مقایسهای مانند آزمون کایدو، t-test مستقل یا آنالیز واریانس استفاده شد. سطح معناداری آماری در تمامی آزمونها کمتر از ۰.۰۵ در نظر گرفته شد. دادهها بهصورت جدول و نمودار ارائه گردیدند.
ملاحظات اخلاقی
پروتکل این مطالعه توسط کمیته اخلاق پژوهشی منطقه تاپاند (Top End Human Research Ethics Committee) مورد بررسی و تأیید قرار گرفت. با توجه به ماهیت گذشتهنگر مطالعه و استفاده از دادههای ثبتشده، دریافت رضایتنامه کتبی از بیماران ضروری نبود. با این حال، تمامی اطلاعات با رعایت اصول محرمانگی و ناشناسسازی مورد تحلیل قرار گرفتند. این مطالعه مطابق با استانداردهای اخلاقی بیانیه هلسینکی و راهنمای ملی پژوهشهای انسانی استرالیا انجام شد.
ویژگیهای جمعیت مورد مطالعه
سن، جنس، قومیت و محل سکونت بیماران
در این مطالعه، ۸۵ بیمار با تشخیص قطعی گال نروژی در طی بازه زمانی ۱۶ ساله مورد بررسی قرار گرفتند. میانگین سنی بیماران در زمان بروز اولین اپیزود گال نروژی ۵۰.۷ سال بود (با دامنه بین ۶ تا ۹۵ سال). توزیع سنی بیماران بیانگر آن بود که اگرچه بیماری میتواند در تمامی گروههای سنی رخ دهد، اما شیوع بالاتری در بزرگسالان میانسال و سالمند مشاهده میشود.
از نظر جنسیت، اکثریت بیماران مرد بودند (۶۴.۷ درصد). این نسبت میتواند نشاندهنده عوامل رفتاری، شغلی یا تفاوتهای دسترسی به خدمات درمانی در بین مردان و زنان باشد.
در رابطه با قومیت، ۹۰.۶ درصد از بیماران (۷۷ نفر) از میان جمعیت بومی استرالیا (Aboriginal Australians) بودند. این یافته نشاندهنده بار نامتناسب بیماری در میان جمعیتهای بومی است که اغلب در مناطق دورافتاده یا دارای زیرساختهای بهداشتی ضعیف زندگی میکنند.
از نظر محل سکونت، ۸۰ درصد بیماران در مناطق روستایی و بسیار دوردست (remote communities) زندگی میکردند. این مناطق معمولاً با چالشهای متعددی از جمله کمبود خدمات سلامت اولیه، عدم دسترسی به درمان استاندارد، و فقدان نظام پایش مؤثر مواجه هستند.
وضعیت ابتلا به بیماریهای زمینهای و ایمنی
بیش از نیمی از بیماران (۵۴.۱ درصد) دارای نقص ایمنی زمینهای بودند. شایعترین شرایط ایمنی سرکوبشده شامل ابتلا به HTLV-1 (ویروس لنفوتروپ انسانی نوع ۱)، دیابت ملیتوس، بیماری کلیوی مزمن، سوءتغذیه مزمن و اعتیاد به الکل بود. وجود این بیماریها نهتنها خطر ابتلا به گال نروژی را افزایش میدهد، بلکه به بروز فرمهای شدیدتر، پاسخ درمانی ضعیفتر و احتمال عود مکرر نیز میانجامد.
بهویژه HTLV-1 که در میان جمعیت بومی استرالیا شیوع نسبتاً بالایی دارد، بهعنوان یکی از عوامل کلیدی در پاتوژنز گال نروژی شناخته میشود. این ویروس با اختلال در عملکرد لنفوسیتهای T، کاهش ایمنی سلولی و التهاب مزمن پوستی میتواند زمینه را برای تکثیر بیرویه کنه فراهم سازد.
وضعیت بهداشتی و اجتماعی مناطق بومی بیماران
بررسی اجتماعی-زیستی جمعیت مورد مطالعه نشان داد که اکثر بیماران در محیطهایی با شرایط بهداشتی بسیار ضعیف زندگی میکردند. در مناطق بومی دوردست که بیماران عمدتاً از آنجا آمده بودند، مشکلاتی مانند تراکم بالای جمعیت در خانهها، عدم دسترسی به آب لولهکشی پایدار، کمبود امکانات شستوشو و نظافت، و فقدان آموزش سلامت عمومی بهطور گسترده مشاهده میشود.
این شرایط نهتنها خطر انتقال فرد به فرد گال را افزایش میدهند، بلکه موجب پنهانماندن بیماری و تأخیر در مراجعه برای درمان نیز میشوند. همچنین، محرومیت از خدمات درمانی تخصصی، کمبود نیروی انسانی آموزشدیده، و نبود ساختارهای مراقبتی پیوسته، باعث شدهاند بسیاری از بیماران تنها در مراحل پیشرفته و پیچیده بیماری به سیستم سلامت مراجعه کنند.
در مجموع، الگوی جمعیتی بیماران در این مطالعه بیانگر تداخل عوامل بالینی، ایمنی و اجتماعی در بروز و تداوم گال نروژی است؛ مسئلهای که تأکید بیشتری بر لزوم رویکردی چندبعدی برای پیشگیری، تشخیص زودهنگام و مراقبت جامع از بیماران درگیر با این بیماری میطلبد.
شدت بیماری و طبقهبندی بالینی
درجهبندی گال نروژی بر اساس عمق و وسعت ضایعات، سابقه ابتلا و شرایط پوستی
برای توصیف شدت گال نروژی در این مطالعه، از یک نظام درجهبندی بالینی سهمرحلهای استفاده شد که عوامل مختلفی از جمله وسعت ضایعات پوستی، عمق درگیری پوست، تعداد اپیزودهای قبلی گال نروژی، وضعیت پوستی زمینهای (مانند ایکتیوز یا درماتوزهای مزمن)، و وجود عفونت ثانویه را در نظر میگرفت.
- درجه ۱ (خفیف): ضایعات محدود، بدون درگیری گسترده لایههای شاخی، بدون سابقه قبلی گال نروژی یا همراه با بیماری زمینهای خفیف.
- درجه ۲ (متوسط): ضایعات پوستی نسبتاً گسترده با هیپرکراتوز قابل توجه، احتمال وجود سابقه یک یا دو اپیزود قبلی، یا زمینه پوستی مساعد.
- درجه ۳ (شدید): درگیری وسیع با پوستهریزی ضخیم، تجمع انبوه کنهها، عود مکرر بیماری و/یا همراهی با بیماریهای زمینهای شدید مانند HTLV-1، دیابت کنترلنشده یا نارسایی کلیوی.
فراوانی بیماران در هر گروه شدت (درجه ۱ تا ۳)
از میان ۸۵ بیمار:
- ۱۸ نفر (۲۱.۲ درصد) در گروه درجه ۱ (خفیف) قرار گرفتند.
- ۲۵ نفر (۲۹.۴ درصد) در گروه درجه ۲ (متوسط) دستهبندی شدند.
- ۴۲ نفر (۴۹.۴ درصد) دارای گال نروژی درجه ۳ (شدید) بودند.
بیش از نیمی از بیماران مبتلا به گال نروژی شدید بودند که نشاندهنده مراجعه دیرهنگام، تشخیص با تأخیر و حضور بیماریهای زمینهای پیچیده است.
شاخصهای بالینی و محل شایع بروز ضایعات پوستی
بیماران اغلب با ضایعات ضخیم، پوستهدار و هیپرکراتوتیک مراجعه میکردند. محلهای شایع بروز این ضایعات شامل:
- دستها و انگشتان (۹۲ درصد)
- پاها و انگشتان پا (۷۸ درصد)
- پوست سر، گوشها و صورت (۴۵ درصد)
- پشت و تنه (۳۱ درصد)
- ناحیه تناسلی و چینهای پوستی (۲۲ درصد)
در موارد شدید، درگیری تمام بدن (generalized crusting) مشاهده شد و در برخی بیماران، کراتین ضخیم و ترکخورده تا حدی بود که منجر به خونریزی یا زخمهای باز شده بود.
علائم عمومی و اختصاصی
خارش، که علامت شایع گال معمولی است، در ۴۷ درصد از بیماران گال نروژی گزارش شد. این میزان پایین را میتوان به نقایص ایمنی یا اختلالات عصبی بیماران نسبت داد. سایر علائم عمومی عبارت بودند از:
- بیقراری یا تحریکپذیری (بویژه در سالمندان)
- تب خفیف در موارد همراه با عفونت ثانویه
- بوی بد ضایعات، ناشی از آلودگی باکتریایی
برخی بیماران علائمی از کاهش وزن، سوءتغذیه یا اختلال عملکردی اعضای بدن را نیز نشان میدادند که ممکن است به بار بیماری مزمن مرتبط باشد.
یافتههای هماتولوژیک و ایمونولوژیک
مطالعات آزمایشگاهی نشان داد که بیماران درجات مختلفی از پاسخ ایمنی غیرطبیعی داشتند:
- ائوزینوفیلی در ۵۳ درصد از بیماران مشاهده شد که نشاندهنده فعالسازی ایمنی علیه انگل است.
- نوتروفیلی، بهویژه در بیماران دارای عفونت ثانویه، در ۳۸ درصد موارد گزارش شد.
- IgE سرمی در اکثریت بیماران بالا بود و با شدت بیماری همبستگی نسبی داشت.
- سطح پایین مکمل C3 در برخی بیماران با عفونت مزمن دیده شد که میتواند بیانگر مصرف مداوم در پاسخ التهابی باشد.
این یافتهها نشان میدهند که گال نروژی نهتنها یک بیماری پوستی، بلکه یک اختلال ایمنی-التهابی سیستمیک است که باید با دید چندجانبه درمان و پیگیری شود.
درمان و پاسخ به درمان
داروهای تجویزی (ایورمکتین، اسکابیسید موضعی، کراتولیتیکها)
درمان بیماران مبتلا به گال نروژی در این مطالعه بهصورت ترکیبی و چندمرحلهای انجام شد. سه گروه اصلی دارویی مورد استفاده قرار گرفت:
- ایورمکتین خوراکی: شایعترین داروی سیستمیک مورد استفاده بود. ایورمکتین با دوز ۲۰۰ میکروگرم به ازای هر کیلوگرم وزن بدن، معمولاً در چند نوبت به فواصل ۲ تا ۳ روز تجویز میشد. بیماران با شدت بالاتر، دوزهای بیشتری دریافت کردند؛ در برخی موارد، تا ۷ دوز در طول درمان تجویز شد.
- اسکابیسیدهای موضعی: شامل پرمترین ۵٪ و در موارد محدود، بنزیل بنزوات. این داروها برای کل بدن، از گردن به پایین، و در برخی بیماران بر روی سر نیز استفاده میشدند. درمان موضعی معمولاً حداقل دو بار، با فاصله یک هفته تکرار میشد.
- کراتولیتیکها: مانند اسید سالیسیلیک یا اوره موضعی، برای تسهیل نفوذ داروهای ضدکنه در ضایعات ضخیم و هیپرکراتوتیک استفاده میشدند. در موارد شدید، برداشتن فیزیکی پوستهها نیز انجام میگرفت.
دوزهای پیشنهادی بر اساس شدت بیماری
- درجه ۱ (خفیف): دو دوز ایورمکتین (روز ۰ و روز ۷) + یک یا دو بار درمان موضعی
- درجه ۲ (متوسط): ۳–۵ دوز ایورمکتین طی دو هفته + درمان موضعی تکرارشونده + کراتولیتیک
- درجه ۳ (شدید): حداقل ۵ دوز ایورمکتین، در برخی موارد تا ۷ دوز + درمان موضعی مکرر (تا ۵ بار) + اقدامات تهاجمیتر برای پوستهبرداری و پیشگیری از عفونت
موفقیت درمان، مدت بستری، موارد بستری در ICU، درمانهای ناقص
میانگین مدت بستری بیماران ۲۳.۶ روز بود، با دامنهای از ۵ تا ۹۰ روز. از میان ۸۵ بیمار:
- ۷۱ نفر (۸۳.۵٪) درمان موفق داشتند و بدون شواهد عود مرخص شدند.
- ۱۴ نفر (۱۶.۵٪) به دلیل بیماریهای زمینهای شدید، عدم پاسخ مناسب یا عوارض، نیاز به بستری مجدد یا مراقبت ویژه داشتند.
- ۹ بیمار (۱۰.۶٪) در طول بستری به ICU منتقل شدند، عمدتاً به دلیل عفونتهای باکتریایی همزمان یا وضعیت سیستمیک ناپایدار.
در ۲۷ درصد از بیماران، درمان اولیه ناقص بود. این موارد عمدتاً ناشی از ترک درمان، عدم دسترسی به دارو، یا چالشهای مراقبتی در مناطق دوردست پس از ترخیص بودند.
عود بیماری و اپیزودهای تکراری
تعریف و تشخیص موارد عود
عود بیماری در این مطالعه بهصورت بازگشت علائم بالینی همراه با شواهد تأییدکننده میکروسکوپی یا هیستوپاتولوژیک، حداقل دو هفته پس از تکمیل درمان قبلی تعریف شد. برای افتراق بین عود واقعی و درمان ناقص اولیه، سابقه دارویی دقیق و ارزیابی مجدد شدت ضایعات در نظر گرفته شد.
فاصله زمانی بین اپیزودها
از مجموع ۸۵ بیمار، ۲۹ نفر (۳۴.۱٪) حداقل یک اپیزود عود بیماری را تجربه کردند. میانگین فاصله بین اپیزودها ۷.۳ ماه (با دامنه ۱ تا ۲۴ ماه) بود. در بیماران با گال نروژی درجه ۳، احتمال بروز عود در سال اول پس از درمان اولیه بهطور معناداری بیشتر بود.
در برخی موارد، اپیزودهای عود با شدت بیشتر و درگیری پوستی گستردهتری همراه بود، که نشاندهنده ضعف پاسخ ایمنی پایدار و احتمال وجود منابع پنهان انتقال در محیط زندگی بیماران بود.
عوامل مستعدکننده عود (دیابت، HTLV-1، اعتیاد، فقر)
تحلیل عوامل خطر نشان داد که بیماران دارای شرایط زیر، در معرض خطر بالاتری برای عود بیماری بودند:
- HTLV-1 مثبت: ۷۵٪ از بیماران با عود، دارای عفونت همزمان HTLV-1 بودند.
- دیابت کنترلنشده: ۴۸٪ از بیماران دچار عود، سابقه دیابت با HbA1c بالا داشتند.
- اعتیاد به الکل یا مواد: در ۴۰٪ از موارد عود، وابستگی به الکل یا مصرف تزریقی مواد گزارش شده بود.
- زندگی در مناطق دوردست با شرایط فقر شدید: کمبود دسترسی به مراقبتهای پیگیرانه و قطع پیدرپی درمان در این بیماران بسیار رایج بود.
این نتایج نشان میدهد که کنترل موفق گال نروژی صرفاً به درمان دارویی وابسته نیست، بلکه نیازمند مداخلات جامع اجتماعی، بهداشتی و رفتاری است که عوامل مستعدکننده زمینهای را نیز هدف قرار دهد.
مرگومیر و پیامدهای بیماری
میزان مرگ در حین بستری و پس از ترخیص
در میان ۸۵ بیمار مبتلا به گال نروژی که در این مطالعه مورد بررسی قرار گرفتند، ۱۸ بیمار (۲۱.۲٪) در طی مدت پیگیری جان خود را از دست دادند. از این میان، ۱۰ مورد (۵۵.۶٪) در حین بستری درگذشتند و ۸ مورد دیگر (۴۴.۴٪) در کمتر از ۱۲ ماه پس از ترخیص فوت کردند. میانگین مدت زمان تا مرگ پس از ترخیص ۹.۵ هفته بود. این آمار، گال نروژی را نهتنها یک عفونت پوستی بلکه یک عامل جدی تهدیدکننده حیات، بهویژه در جمعیتهای آسیبپذیر، معرفی میکند.
ارتباط مرگ با بیماری زمینهای یا عفونت ثانویه
در بررسی علل مرگ، مشخص شد که اغلب موارد مرگ ناشی از عوارض ثانویه یا بیماریهای زمینهای شدید بودهاند که در بستر گال نروژی تشدید شده بودند. از میان بیماران فوتشده:
- ۱۳ نفر (۷۲.۲٪) دارای بیماری زمینهای شدید مانند نارسایی کلیوی، دیابت کنترلنشده یا سوءتغذیه مزمن بودند.
- ۸ نفر (۴۴.۴٪) شواهدی از عفونت ثانویه شدید، از جمله باکتریمی و سپسیس داشتند که بهعنوان علت مستقیم مرگ شناخته شد.
یافتهها نشان میدهد که گال نروژی میتواند زمینهساز عفونتهای سیستمیک و اختلالات ایمنی گسترده شود و در بیماران دچار ضعف سیستم ایمنی، پیامدهای بالقوه کشنده ایجاد کند.
عوارض ثانویه و عفونتهای همزمان
باکتریمی، عفونتهای پوستی و سیستمیک
در بیش از نیمی از بیماران (۵۳٪)، عفونتهای ثانویه گزارش شد. این عفونتها شامل:
- سلولیت، امپتیگو و زخمهای چرکی پوست (۳۲ مورد)
- باکتریمی قطعی با استافیلوکوک اورئوس یا استرپتوکوک گروه A (۱۵ مورد)
- سپسیس سیستمیک منجر به بستری در ICU (۹ مورد)
وجود کراتین ضخیم و ترکخورده در ضایعات گال نروژی، محیط مساعدی برای رشد و نفوذ باکتریها ایجاد میکند. همچنین، خاراندن ضایعات توسط بیماران یا مراقبین، میتواند ورود پاتوژنها به جریان خون را تسهیل کند.
در برخی موارد، شواهد آسیب کلیوی، شوک سپتیک یا پنومونی نیز بهعنوان عوارض سیستمیک مرتبط با گال نروژی گزارش شدهاند.
نیاز به آنتیبیوتیک و مراقبتهای ویژه
در مجموع، ۶۱ بیمار (۷۱.۸٪) نیاز به دریافت آنتیبیوتیک سیستمیک داشتند که در اغلب موارد بهصورت تزریقی و با طیف وسیع تجویز شد. داروهایی نظیر وانکومایسین، پنیسیلین تزریقی و سفالوسپورین نسل سوم، رایجترین انتخابها بودند.
همچنین، ۹ بیمار (۱۰.۶٪) به علت سپسیس، افت فشار خون یا نارسایی تنفسی، در بخش مراقبتهای ویژه (ICU) بستری شدند. این موارد اغلب در بیمارانی با شدت گال درجه ۳، عفونت همزمان باکتریایی و بیماریهای زمینهای شدید رخ داد.
در نهایت، این یافتهها اهمیت شناسایی زودهنگام، درمان تهاجمی، و پایش مستمر بیماران گال نروژی را نشان میدهند. موفقیت درمان صرفاً به حذف کنه محدود نمیشود، بلکه به مدیریت جامع عفونت، تغذیه، ایمنی و مراقبتهای حمایتی نیز وابسته است.
پیامدهای بهداشت عمومی و سیاستگذاری
نقش بیماران بدون تشخیص در شیوع در مراکز جمعی
یکی از تهدیدات اصلی در مدیریت گال نروژی، حضور بیماران بدون تشخیص یا دیر تشخیصدادهشده در محیطهای پرجمعیت مانند خانههای سالمندان، مراکز مراقبت بلندمدت، پناهگاهها و مراکز نگهداری افراد با نیازهای خاص است. این بیماران، بهویژه در مراحل اولیه بیماری که هنوز ایزوله نشدهاند، منبع پنهانی انتقال محسوب میشوند و میتوانند سبب اپیدمیهای خوشهای در محیطهای بسته گردند. عدم آگاهی کادر درمان و مراقبین از نشانههای گال نروژی و شباهت ظاهری ضایعات آن با سایر بیماریهای پوستی، تشخیص زودهنگام را دشوارتر میسازد.
تأثیر گال نروژی بر شکست برنامههای درمان جمعی
برنامههای درمان جمعی (Mass Drug Administration – MDA) از راهکارهای کلیدی کنترل گال در سطح جمعیت هستند. اما حضور حتی یک مورد درماننشده گال نروژی، میتواند این مداخلات گسترده را به شکست بکشاند. بیماران مبتلا به گال نروژی، با بار بالای انگلی، بهطور مداوم به محیط اطراف کنه منتشر میکنند و اغلب نیاز به درمانهای متعدد و طولانیتر دارند. اگر این موارد شناسایی نشده یا بهطور ناقص درمان شوند، بازگشت بیماری به جامعه پس از اجرای MDA اجتنابناپذیر خواهد بود.
اهمیت غربالگری، آموزش پرسنل و ایجاد «مناطق عاری از گال»
برای مهار مؤثر گال نروژی، غربالگری هدفمند بیماران پرخطر در بدو ورود به مراکز جمعی یا هنگام بروز خارش غیرعادی ضروری است. در کنار آن، آموزش منظم و تخصصی برای کادر درمان، پرسنل مراقبتی، خانوادهها و حتی بیماران باید نهادینه شود.
ایجاد «مناطق عاری از گال» با اجرای همزمان غربالگری، درمان کامل، ایزولاسیون مؤثر و آموزش جمعی، میتواند گام مهمی در کنترل پایدار این بیماری باشد. مناطق بهداشتی بدون گال، زمینه را برای پیادهسازی موفق سیاستهای بهداشتی گستردهتر فراهم میکنند.
پیشنهادات برای کنترل مؤثر بیماری
طراحی مدلهای کنترل عفونت در مناطق بومی
مداخلات کنترل عفونت باید متناسب با شرایط فرهنگی، جغرافیایی و اجتماعی مناطق بومی طراحی شوند. استفاده از کادر محلی آموزشدیده، مشارکت رهبران اجتماعی، و طراحی پروتکلهای درمانی قابل اجرا در مناطق دوردست، نقش کلیدی در مهار بیماری دارند. همچنین، باید اقدامات تسهیلگر برای انتقال ایمن بیماران، تأمین دارو، و نظارت بالینی پیوسته فراهم شود.
پیگیری بیماران پس از ترخیص
بیش از یکسوم موارد عود در این مطالعه به دلیل فقدان پیگیری درمانی پس از ترخیص بوده است. بنابراین، طراحی سیستمهای پیگیری فعال و ارتباط مستمر بین بیمارستان و مراکز مراقبت اولیه، میتواند از بازگشت بیماری جلوگیری کند. ارائه بستههای درمان خانگی، برقراری تماس تلفنی، یا پیگیری حضوری توسط مراقبین محلی، از جمله ابزارهای مؤثر در این زمینه است.
اصلاح ساختارهای اجتماعی، بهداشتی و آموزشی
تداوم شیوع گال نروژی در مناطق خاص، بازتاب نابرابریهای ساختاری در حوزه بهداشت و آموزش است. کمبود زیرساختهای بهداشتی، فقر، تراکم بالای جمعیت در خانهها، و نبود برنامههای آموزش سلامت عمومی از جمله عوامل تسهیلکننده شیوع بیماری هستند. سرمایهگذاری در بهبود زیرساختها، ارتقای سواد سلامت، بهبود کیفیت مراقبت در مناطق محروم، و حمایت از جوامع بومی، بخشی جداییناپذیر از کنترل پایدار گال نروژی است.
جمعبندی و چشمانداز آینده
گال نروژی نهتنها یک بیماری انگلی پوستی، بلکه یک چالش سیستمیک در حوزه سلامت عمومی است که نیازمند مداخلات چندلایه و همزمان بالینی، اجتماعی، و سیاستگذاری است. تشخیص زودهنگام، درمان کامل و پیگیری فعال بیماران، ارکان اصلی موفقیت در مهار این بیماری هستند. در غیاب این اقدامات، گال نروژی میتواند همچنان منبع شکست مداخلات جمعی و گسترش عفونتهای خطرناک باقی بماند.
از منظر پژوهشی، توسعه داروهای نوین با اثرگذاری پایدار، طراحی واکسن مؤثر علیه کنه، و بهکارگیری فناوریهای مولکولی برای تشخیص سریع باید در اولویت قرار گیرد. همچنین، تحقیقات اجتماعی-رفتاری برای شناسایی موانع درمان در جوامع بومی و طراحی راهکارهای مشارکتمحور در کنترل بیماری ضروری است.
در نهایت، تأکید بر سیاستگذاری منطقهای مبتنی بر شواهد، همراه با منابع پایدار مالی و انسانی، مسیر دستیابی به کنترل مؤثر گال نروژی را هموار خواهد کرد. بدون توجه به این بیماری و پیامدهای آن، نمیتوان چشماندازی واقعی برای مهار جهانی گال ترسیم کرد.

بدون دیدگاه