توجه: این یک مقاله علمی در مورد گال است، چنانچه نیازمند اطلاعات عمومی در مورد بیماری گال هستید، مطالعه مقاله ” گال چیست؟ ” پیشنهاد میشود.
چکیده
گال یکی از بیماریهای نادیدهگرفتهشده استوایی (NTD) پوستی است که توسط کنه Sarcoptes scabiei ایجاد میشود و با خارش شدید و عفونتهای ثانویه باکتریایی همراه است. این بیماری در بسیاری از کشورهای کمدرآمد بهدلیل شرایط بهداشتی نامناسب و تراکم بالای جمعیت، یک معضل سلامت عمومی محسوب میشود. تشخیص دقیق و سریع گال، پیش از آغاز درمان فردی یا اجرای مداخلات جمعی مانند تجویز گسترده آیوِرمکتین، از اهمیت بالایی برخوردار است. با وجود پیشرفتهای تکنولوژیک در سالهای اخیر، هنوز روش تشخیصی استاندارد و قابلدسترسی برای استفاده در مراکز درمانی اولیه یا محیطهای کمامکانات وجود ندارد.
این مقاله مروری به بررسی و تحلیل آخرین وضعیت روشهای آزمایشگاهی تشخیص گال میپردازد. روشهایی چون میکروسکوپی مستقیم، آسیبشناسی بافتی، آزمونهای سرولوژیک، تکنیکهای مبتنی بر واکنش زنجیرهای پلیمراز (PCR)، و روشهای جدیدی نظیر تقویت ایزوترمال حلقوی (LAMP) مورد بررسی قرار گرفتهاند. در حالی که برخی از این روشها مانند میکروسکوپی و درموسکوپی در عمل بالینی مورد استفاده قرار میگیرند، سایر تکنیکها هنوز مراحل اعتبارسنجی یا توسعه را طی میکنند.
نتایج نشان میدهد که اگرچه روشهای مولکولی از نظر حساسیت و ویژگی در شرایط کنترلشده عملکرد بالایی دارند، اما چالشهایی مانند نیاز به تجهیزات تخصصی و فرآیندهای پیچیده استخراج DNA، مانع از کاربرد گسترده آنها در محیطهای کممنبع شده است. همچنین، آزمونهای سرولوژیک با وجود نویدهایی که در مطالعات آزمایشگاهی دادهاند، هنوز به استاندارد بالینی نرسیدهاند.
توسعه تستهای نقطهای ساده، ارزان و قابل استفاده در شرایط میدانی، همراه با استانداردسازی روشهای نمونهبرداری، میتواند به تحقق تشخیص زودهنگام و مدیریت مؤثرتر بیماری گال منجر شود. این مرور، چشمانداز جامعی از پیشرفتها، چالشها و فرصتهای آینده در زمینه تشخیص آزمایشگاهی این بیماری را ارائه میدهد.
مقدمه
گال یک بیماری پوستی مسری ناشی از انگل خارجی Sarcoptes scabiei است که بهعنوان یکی از بیماریهای نادیدهگرفتهشده استوایی (Neglected Tropical Diseases – NTDs) توسط سازمان جهانی بهداشت طبقهبندی شده است. با وجود شیوع گسترده آن در بسیاری از نقاط جهان، بهویژه در کشورهای با منابع محدود، توجه کافی به این بیماری از سوی نظامهای بهداشتی و پژوهشگران در دهههای گذشته وجود نداشته است. برآوردها نشان میدهد که بیش از ۱۳۰ میلیون نفر در جهان به این بیماری مبتلا هستند و بیشترین بار بیماری در مناطق گرمسیری و کمبرخوردار مانند جنوب صحرای آفریقا، اقیانوس آرام غربی و آمریکای لاتین دیده میشود.
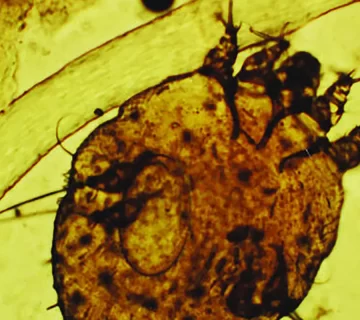
عامل بیماری، کنهای است که در لایههای سطحی پوست انسان تونلزنی میکند و موجب بروز واکنش التهابی و خارش شدید میشود. در بسیاری از موارد، بهویژه در جمعیتهای آسیبپذیر مانند کودکان، سالمندان یا افراد با نقص سیستم ایمنی، عفونت ثانویه باکتریایی با عوامل Streptococcus یا Staphylococcus aureus رخ میدهد که میتواند به عوارض خطرناکتری همچون سپسیس، گلومرولونفریت یا تب روماتیسمی منجر شود.
یکی از چالشهای اساسی در مدیریت بیماری گال، دشواری در تشخیص قطعی آن است. علائم بالینی این بیماری میتواند در مراحل مختلف، یا در حضور عفونتهای همزمان، بهصورت غیراختصاصی ظاهر شود و حتی با بیماریهایی مانند اگزما، پسوریازیس یا درماتیت تماسی اشتباه گرفته شود. همچنین، در فرمهای غیرمعمول مانند “گال دلمهای (crusted scabies)”، که اغلب در بیماران دارای نقص ایمنی دیده میشود، بار انگل بسیار بالا است اما علائم کلاسیک خارش ممکن است مشاهده نشود.
در چنین شرایطی، اتکای صرف به معاینه بالینی ممکن است منجر به تشخیص نادرست، تأخیر در درمان و گسترش بیشتر عفونت شود. به همین دلیل، استفاده از روشهای آزمایشگاهی جهت تأیید تشخیص و پایش اثربخشی درمان اهمیت فزایندهای یافته است. روشهای موجود شامل میکروسکوپی مستقیم، آسیبشناسی بافتی، آزمونهای سرولوژیک، تکنیکهای مولکولی مبتنی بر DNA و اخیراً روشهای تقویت ایزوترمال هستند. هر یک از این روشها دارای نقاط قوت و محدودیتهایی در زمینه دقت، سرعت، هزینه، نیاز به تجهیزات و قابلیت استفاده در مناطق با منابع محدود میباشند.
هدف این مقاله مروری، بررسی جامع وضعیت فعلی روشهای تشخیص آزمایشگاهی گال و تحلیل انتقادی مزایا، محدودیتها و چشمانداز توسعه آنها برای استفاده در محیطهای بالینی و میدانی است. با تکیه بر یافتههای علمی منتشر شده تا سال ۲۰۲۲، این مرور تلاش میکند تا شکافهای موجود در دانش تشخیصی بیماری را شناسایی کرده و جهتگیریهایی برای بهبود راهکارهای آتی در کنترل و درمان گال ارائه دهد.
روشهای سنتی تشخیص آزمایشگاهی
با وجود پیشرفتهای تکنولوژیک در حوزه تشخیص بیماریهای عفونی، بسیاری از مراکز درمانی، بهویژه در مناطق کمبرخوردار، همچنان به روشهای سنتی برای تشخیص گال متکی هستند. این روشها که عمدتاً شامل میکروسکوپی مستقیم و آسیبشناسی بافتی هستند، اگرچه مزایای خاصی دارند، اما با چالشهایی نیز همراهاند که کاربرد آنها را محدود میسازد.
میکروسکوپی مستقیم (Direct Microscopy)
میکروسکوپی مستقیم همچنان بهعنوان یکی از روشهای پایه و قابل اعتماد برای تشخیص گال شناخته میشود. در این روش، ناحیهای از پوست که مشکوک به تونلزنی کنه است، خراش داده میشود و نمونه برداشتهشده روی لام قرار میگیرد. سپس، ۵ قطره از محلول KOH 10٪ یا نرمال سالین به نمونه افزوده شده و یک لامل روی آن قرار داده میشود. نمونه زیر میکروسکوپ نوری بررسی میگردد تا وجود کنه بالغ، لارو یا تخمها (ova) تأیید شود.
این روش در صورت اجرای صحیح، دقت بالایی دارد، اما اجرای موفق آن به مهارت تکنسین، انتخاب صحیح محل نمونهبرداری، و سرعت انتقال نمونه به آزمایشگاه وابسته است. در مناطق دورافتاده یا فاقد آزمایشگاه، حفظ کیفیت نمونه و انجام درست فرایند میکروسکوپی چالشبرانگیز است. با این حال، این روش برای تأیید قطعی حضور انگل در پوست فرد، بهویژه در مراحل پیشرفته بیماری، کارآمد و ارزان است.
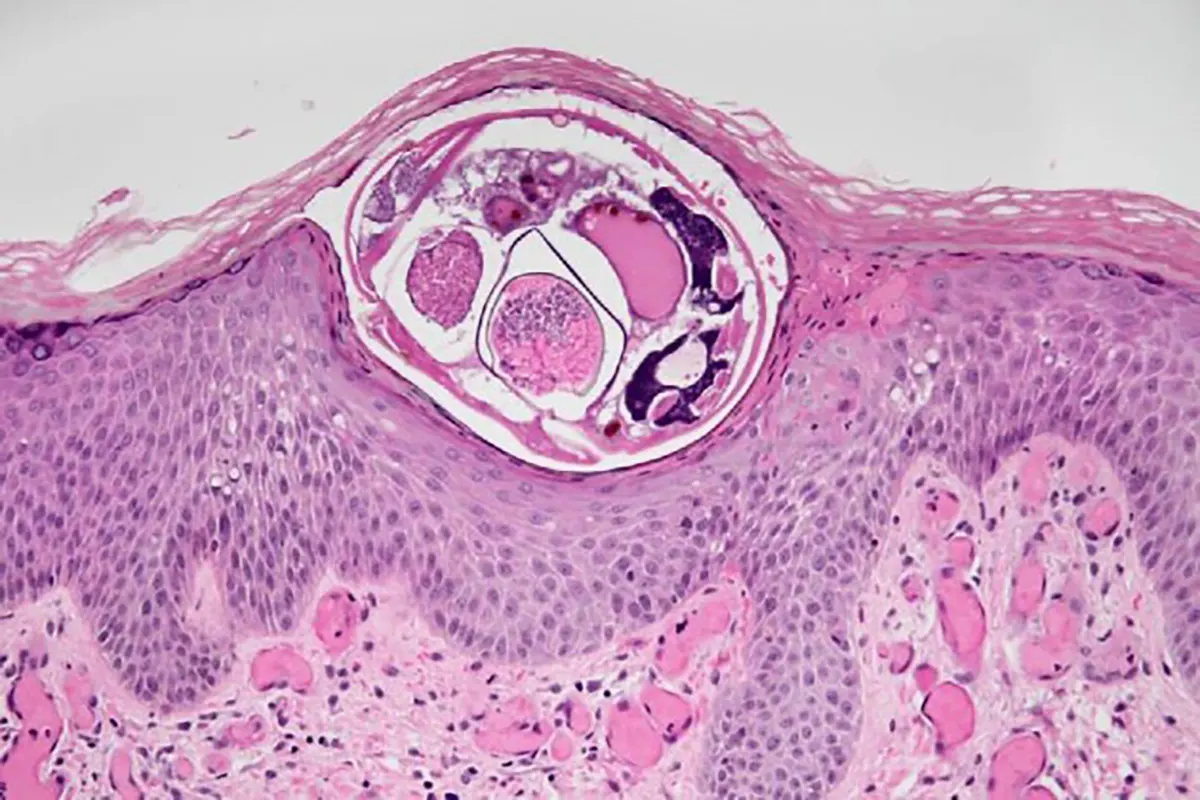
آسیبشناسی بافتی (Histopathology)
آسیبشناسی یکی دیگر از روشهای دقیق برای تشخیص گال، بهویژه در موارد غیرکلاسیک یا مقاوم به درمان است. در این روش، نمونه پوست از ناحیه درگیر برداشته شده و بلافاصله در محلول فرمالین ۱۰٪ فیکس میشود. پس از آمادهسازی برشهای میکروسکوپی (۳ تا ۵ میکرومتر)، نمونهها با رنگ هماتوکسیلین-ائوزین (H&E) رنگآمیزی شده و در زیر میکروسکوپ بررسی میشوند.
در بررسی آسیبشناختی، ساختارهای مختلف انگل شامل اسکلت خارجی، تخم، فرمهای نابالغ و مدفوع کنه (scybala) قابل مشاهده هستند. از جمله تغییرات بافتی مشاهدهشده میتوان به هایپرکراتوز، آکانتوز، اسفنجی شدن اپیدرم، واسکولیت و وجود ترومبوز فیبرینی در عروق سطحی اشاره کرد. در مواردی که تشخیص بر اساس رنگآمیزی H&E دشوار باشد، استفاده از میکروسکوپ پلاریزان بهمنظور شناسایی اجزای غیرقابل رنگآمیزی توصیه میشود.
با وجود دقت بالای این روش، کاربرد آن بهصورت روتین در مراکز بالینی رایج نیست، چرا که هم زمانبر است (۲ تا ۷ روز برای آمادهسازی و بررسی نمونه)، و هم نیاز به تجهیزات پیشرفته و مهارت آسیبشناس دارد. همچنین، نمونهبرداری تهاجمی بوده و ممکن است برای بیمار ناراحتکننده باشد.
نقاط قوت و محدودیتهای روشهای سنتی
| ویژگی | میکروسکوپی مستقیم | آسیبشناسی بافتی |
|---|---|---|
| دقت (در صورت اجرای صحیح) | بالا | بسیار بالا |
| زمان دستیابی به نتیجه | سریع (چند دقیقه تا یک ساعت) | کند (۲ تا ۷ روز) |
| هزینه | پایین | بالا |
| نیاز به تجهیزات تخصصی | متوسط | بالا |
| قابلیت اجرا در مناطق کمبرخوردار | نسبتاً بالا | پایین |
| تهاجمی بودن روش | کم | بالا |
روشهای سرولوژیک
روشهای سرولوژیک یکی از حوزههای نوظهور در تشخیص گال هستند که با هدف شناسایی آنتیبادیها یا آنتیژنهای خاص کنه Sarcoptes scabiei در سرم بیماران طراحی شدهاند. این روشها از پتانسیل بالایی برای غربالگری، تشخیص سریع و همچنین پایش درمان برخوردارند، اما هنوز به سطح استانداردهای تشخیص روتین در کلینیکها نرسیدهاند. دلیل این امر، پیچیدگی در تولید آنتیژنهای خاص، تداخل با سایر آلرژنها و محدودیت در مطالعات انسانی است.
آزمونهای مبتنی بر آنتیبادی
بیشتر آزمونهای سرولوژیک برای گال، از تکنیک ELISA (Enzyme-Linked Immunosorbent Assay) بهره میبرند. این آزمونها تلاش میکنند تا حضور آنتیبادیهای اختصاصی از کلاسهای مختلف (مانند IgG، IgE، IgA و IgM) علیه آنتیژنهای کنه را شناسایی کنند.
نمونهای از دستاوردهای پژوهشی:
- آزمون ELISA با آنتیژن نوترکیب: در سال ۲۰۱۰، پژوهشی توسط Walton و همکاران، آنتیژنهای اختصاصی از جمله پروتئازهای سیستئینی و آپولیپوپروتئینهای کنه را برای تولید IgE-specific ELISA استفاده کرد. این روش در بیماران مبتلا به گال دلمهای حساسیت ۸۸٪ و ویژگی ۱۰۰٪ داشت.
- آزمون IgE Inhibition Assay: این روش بر پایه شناسایی ممانعت ایمنی توسط IgE عمل میکند. در این آزمون، سطح بالاتری از IgE در بیماران مبتلا به گال نسبت به گروه کنترل دیده شد، بهویژه در مواجهه با آنتیژنهای اپیتلیال کنه.
محدودیتها و چالشها
۱. مشکل در تهیه آنتیژن خالص:
تولید آنتیژن از کنههای انسانی دشوار است، زیرا امکان کشت آزمایشگاهی کنه S. scabiei var. hominis وجود ندارد. معمولاً از نمونههای انسانی دلمهای یا از کنه حیوانی استفاده میشود که ممکن است دقت آزمون را تحت تأثیر قرار دهد.
۲. واکنشهای متقاطع:
آنتیژنهای کنه گال، بهویژه در آزمونهایی که از عصاره کامل کنه استفاده میشود، ممکن است با آلرژنهای کنههای خانگی مانند Dermatophagoides pteronyssinus یا D. farinae واکنش متقاطع نشان دهند، و باعث نتایج کاذب مثبت شوند.
۳. کمبود دادههای انسانی:
بسیاری از مطالعات سرولوژیک در حیوانات آزمایشگاهی مانند خرگوش یا بز انجام شدهاند. هنوز تعداد مطالعات انسانی با جمعیتهای متنوع برای تعیین دقت بالینی این آزمونها محدود است.
سایر تکنولوژیهای سرولوژیک نوین
▪ آزمون DELFIA:
آزمونی مبتنی بر ایمونواسی فلورسانس تقویتشده با لانتانیدها که حساسیت ۱۰۰٪ و ویژگی ۹۳٫۷۵٪ در شرایط آزمایشگاهی داشته است.
▪ استفاده از آنتیژنهای نوترکیب:
آنتیژنهایی مانند SsPTK (پروتئین تیروزین کیناز)، تریوزفسفات ایزومراز، کالمدولین، و چیتیناز مورد استفاده قرار گرفتهاند. این آنتیژنها اغلب در فرم نوترکیب در E. coli تولید شده و در آزمونهای ELISA مورد بررسی قرار گرفتهاند.
جدول مقایسهای برخی از آزمونهای سرولوژیک پیشنهادی
| نوع آنتیژن | نوع آنتیبادی هدف | حساسیت | ویژگی | نقاط قوت | نقاط ضعف |
|---|---|---|---|---|---|
| آپولیپوپروتئین Ssag1.2 | IgE | 88٪ | 100٪ | دقت بالا در گال دلمهای | پیچیدگی فنی |
| پروتئین SsPTK | IgG | 95.2٪ | 94.1٪ | توان تشخیص در مراحل اولیه | داده انسانی محدود |
| آزمون DELFIA | IgE | 100٪ | 93.75٪ | تکنولوژی پیشرفته | نیاز به تجهیزات خاص |
| کوفیلیل خرگوشی | IgG | 83.3٪ | 87.9٪ | کاهش تداخل با کنههای خانگی | بررسی محدود در انسان |
روشهای مولکولی تشخیص گال
روشهای تشخیص مولکولی، بهویژه مبتنی بر واکنش زنجیرهای پلیمراز (PCR)، در سالهای اخیر بهعنوان دقیقترین ابزار برای شناسایی مستقیم Sarcoptes scabiei در نمونههای پوستی شناخته شدهاند. این روشها بر پایه شناسایی قطعات خاصی از DNA انگل بنا شدهاند که دقت بالاتری نسبت به روشهای سنتی و حتی سرولوژیک دارند. با این حال، چالشهایی همچون هزینه، پیچیدگی فنی، نیاز به تجهیزات تخصصی و نمونهبرداری صحیح، استفاده گسترده آنها را در محیطهای بالینی محدود کرده است.
استخراج DNA
استخراج DNA از نمونههای انسانی (پوست، ضایعات، سوآب) اولین گام کلیدی در فرایند تشخیص مولکولی است. بسته به نوع نمونه، از کیتهای تجاری مانند Qiagen Tissue Kit، Nucleospin Tissue Kit یا NucliSENS easyMAG برای جداسازی DNA استفاده میشود. کیفیت DNA به شدت بر صحت نتیجه PCR تأثیرگذار است.
PCR معمولی (Conventional PCR)
یکی از نخستین مطالعات موفق در تشخیص گال با استفاده از PCR در سال ۲۰۰۱ توسط Bezold انجام شد که از توالیهای میکروساتلیت S. scabiei بهعنوان هدف استفاده کرد. در ادامه، توالیهای ژنی مشخصتری برای طراحی پرایمرها به کار گرفته شدند، مانند:
- ژن cox1 (cytochrome c oxidase subunit 1): یک هدف پرکاربرد و اختصاصی برای تشخیص گال انسانی.
- ژنهای میتوکندریایی 16S rDNA و 12S rRNA: با حساسیت بالا برای تشخیص سریع.
- منطقه ITS-2 (Internal Transcribed Spacer 2): برای تفکیک دقیق گونهها و بررسیهای فیلوژنتیکی.
در یکی از مطالعات معتبر، پرایمرهای طراحیشده برای ژن cox1، حساسیت و ویژگی ۱۰۰٪ داشتند و توانستند علاوه بر موارد مثبت با میکروسکوپ، ۱۲ مورد دیگر را نیز که علائم بالینی داشتند اما در میکروسکوپی منفی بودند، شناسایی کنند.
PCR کمّی (Real-Time PCR)
در سال ۲۰۱۵، تکنیکی مبتنی بر qPCR با هدف 121 جفت باز از ژن cox1 طراحی شد که توانست تفاوت در بار ژنتیکی انگل را پیش و پس از درمان نشان دهد. این آزمون نهتنها توان تشخیص دارد، بلکه قابلیت پایش درمان را نیز فراهم میسازد. در بیماران مورد بررسی، بار ژنتیکی S. scabiei تا روزهای ۱۴، ۲۱ و ۲۸ پس از شروع درمان کاهش قابلتوجهی نشان داد.
همچنین، نوعی TaqMan Real-Time PCR نیز بر اساس ژن 16S rDNA طراحی شده که برای تشخیص گال در حیوانات بهکار رفته، اما در آینده میتواند برای گال انسانی نیز بهکار گرفته شود.
RT-PCR (Reverse Transcription PCR)
در سال ۲۰۲۰، روشی مبتنی بر RT-PCR توسط Bae و همکاران طراحی شد که بر ژن cox1 تمرکز داشت. این آزمون بر روی نمونههای خراش پوستی از ۳۳ بیمار مشکوک اجرا شد و حساسیت آن برای موارد تأییدشده ۸۶٪ و ویژگی آن ۱۰۰٪ گزارش شد. این روش بهویژه در موارد غیرکلاسیک و مشکوک بهکارآمدی بالایی داشت.
تکنیکهای نوین تکثیر ایزوترمال (مختص بخش بعدی)
اگرچه PCR از نظر دقت بسیار قابلاتکا است، اما نیاز به ترموسایکلر و خلوص بالای DNA باعث شده که استفاده از آن در مناطق کممنبع یا برای غربالگری جمعی دشوار باشد. به همین دلیل، روشهای ایزوترمال نظیر LAMP در سالهای اخیر مطرح شدهاند که در بخش بعدی بهتفصیل به آنها خواهیم پرداخت.
تکنیکهای تقویت ایزوترمال
روشهای تقویت ایزوترمال، بهعنوان جایگزینهای سادهتر و سریعتر برای PCR، در سالهای اخیر مورد توجه جدی برای تشخیص بیماریهای عفونی قرار گرفتهاند. این تکنیکها، برخلاف PCR که به چرخههای حرارتی نیاز دارد، در دمای ثابت عمل میکنند و در نتیجه نیاز به تجهیزات پیشرفته را کاهش میدهند. در مورد بیماری گال، روش LAMP (Loop-mediated Isothermal Amplification) از مهمترین روشهای ایزوترمال است که پتانسیل بالایی برای استفاده در میدان و مراکز درمانی اولیه دارد.
تکنیک LAMP (تقویت حلقهای ایزوترمال)
LAMP روشی است که با استفاده از مجموعهای از پرایمرهای ویژه، DNA هدف را در دمای ثابت (معمولاً ۶۰ تا ۶۵ درجه سانتیگراد) با سرعت بالا و ویژگی بالا تقویت میکند. این روش میتواند بدون نیاز به ترموسایکلر، در دستگاههای قابل حمل یا حتی با دستگاه گرمکن ساده اجرا شود.
در مطالعهای که در سال ۲۰۱۸ توسط Fraser و همکاران انجام شد، یک LAMP اختصاصی برای Sarcoptes scabiei طراحی و با موفقیت در نمونههای پوستی حیوانات مبتلا به گال (sarcoptic mange) ارزیابی گردید. نتایج این مطالعه به شرح زیر بود:
- حساسیت: 100٪
- ویژگی: 92.3٪
- زمان انجام: کمتر از ۳۰ دقیقه
- سهولت نمونهگیری: سوآب یا خراش پوستی ساده
این آزمون از ژن ITS-2 بهعنوان هدف استفاده کرد و مجموعه پرایمرهای اختصاصی برای آن طراحی شد که در شرایط ایزوترمال، توانست DNA انگل را با دقت بالا شناسایی کند.
مزایای LAMP در مقایسه با PCR
| ویژگی | LAMP | PCR |
|---|---|---|
| نیاز به ترموسایکلر | ❌ | ✅ |
| زمان تقویت | ~30 دقیقه | 1–2 ساعت |
| دمای تقویت | ثابت (60–65°C) | چرخهای (95/55/72°C) |
| قابلیت اجرا در مراکز ابتدایی | بالا | کم |
| حساسیت | بالا | بالا |
| ویژگی | بالا | بالا |
| سهولت تفسیر | قابل مشاهده با چشم غیرمسلح (رنگ یا کدورت) | نیاز به دستگاه خوانش |
سایر تکنیکهای ایزوترمال
گرچه LAMP بیشترین کاربرد را در تشخیص گال داشته، اما دو روش دیگر نیز در حوزه تقویت ایزوترمال قابل بررسیاند:
• RCA (Rolling Circle Amplification):
تکنیکی با حساسیت بالا اما نیازمند طراحی پیچیدهتر پرایمرها. در مورد گال تاکنون بهصورت محدود مورد مطالعه قرار گرفته است.
• MDA (Multiple Displacement Amplification):
برای افزایش مقدار DNA هدف از نمونههای کمحجم استفاده میشود؛ اما در زمینه گال، بیشتر در مطالعات اولیه کاربرد داشته تا تشخیص بالینی.
چالشها و محدودیتها
اگرچه LAMP یک روش بسیار امیدوارکننده است، اما هنوز به عنوان یک روش روتین در تشخیص گال وارد حوزه کاربردی نشده است. دلایل آن عبارتاند از:
- نیاز به اعتبارسنجی در جمعیت انسانی (اکثراً روی حیوانات انجام شدهاند)
- استاندارد نبودن روش نمونهبرداری
- نبود کیتهای تجاری معتبر برای گال انسانی
- تداخل احتمالی با سایر آلودگیهای پوستی در برخی نمونهها
تحلیل مقایسهای روشهای تشخیص آزمایشگاهی گال
با توجه به تنوع گسترده روشهای موجود برای تشخیص گال، از تکنیکهای سنتی گرفته تا روشهای مولکولی و نوین ایزوترمال، تحلیل تطبیقی این روشها از نظر دقت، زمان، تجهیزات مورد نیاز، هزینه، و قابلیت اجرا در مراکز درمانی ضروری است. این مقایسه به متخصصین و سیاستگذاران سلامت کمک میکند تا مناسبترین گزینه را با توجه به شرایط موجود انتخاب کنند.
مقایسه ویژگیهای کلیدی روشهای تشخیص
| روش | حساسیت | ویژگی | زمان دستیابی به نتیجه | تجهیزات مورد نیاز | سطح تهاجم | قابلیت اجرای میدانی |
|---|---|---|---|---|---|---|
| میکروسکوپی مستقیم | متوسط تا بالا | بالا | سریع (15–60 دقیقه) | متوسط (لام، میکروسکوپ) | کم | نسبتاً بالا |
| آسیبشناسی بافتی | بسیار بالا | بسیار بالا | کند (۲ تا ۷ روز) | بالا (آزمایشگاه تخصصی) | زیاد | پایین |
| تستهای سرولوژیک (ELISA) | بالا | بالا (در برخی تستها تا 100٪) | متوسط (۲–۴ ساعت) | بالا | کم | پایین |
| PCR معمولی | بسیار بالا | بسیار بالا | ۲–۳ ساعت | بالا (ترموسایکلر) | متوسط | پایین |
| Real-Time PCR | بسیار بالا | بسیار بالا | ۱–۲ ساعت | بسیار بالا | متوسط | پایین |
| RT-PCR | بسیار بالا | بالا تا بسیار بالا | ۱–۲ ساعت | بسیار بالا | متوسط | پایین |
| LAMP | بالا تا بسیار بالا | بالا | سریع (~30 دقیقه) | پایین تا متوسط | کم | بالا |
نکات مهم در تفسیر جدول
- دقت تشخیصی (حساسیت/ویژگی):
روشهای مولکولی مانند PCR و RT-PCR بالاترین دقت را در تشخیص مستقیم انگل دارند. اما روشهایی مانند LAMP و سرولوژی نیز در مطالعات کنترلشده عملکرد چشمگیری داشتهاند. - قابلیت اجرای میدانی:
روشهایی مانند LAMP و میکروسکوپی مستقیم، با توجه به عدم نیاز به تجهیزات پیچیده، مناسبترین گزینه برای مناطق کممنبع یا در شرایط اپیدمی هستند. - سرعت:
در شرایط اورژانسی یا غربالگری جمعی، LAMP و میکروسکوپی از سریعترین گزینهها محسوب میشوند، در حالی که آسیبشناسی با تأخیر قابلتوجهی همراه است. - هزینه و زیرساخت:
روشهایی مانند PCR و RT-PCR به زیرساختهای آزمایشگاهی پیشرفته، مواد گرانقیمت و تکنسینهای آموزشدیده نیاز دارند و اجرای آنها در مراکز عمومی یا روستایی دشوار است.
کاربرد توصیهشده برای هر روش
| روش | کاربرد مطلوب |
|---|---|
| میکروسکوپی مستقیم | مراکز درمانی اولیه، تشخیص سریع موارد مشکوک |
| آسیبشناسی | تأیید موارد غیرکلاسیک یا مقاوم به درمان |
| سرولوژیک | مطالعات اپیدمیولوژیک، غربالگری جمعی، پیگیری درمان |
| PCR | تشخیص قطعی در مراکز تخصصی، تأیید موارد منفی کاذب |
| LAMP | غربالگری در مناطق دورافتاده، اپیدمیهای جمعی، کاربرد در سیستم سلامت اولیه |
چالشها و شکافهای پژوهشی
علیرغم پیشرفتهای قابلتوجه در حوزه تشخیص آزمایشگاهی بیماری گال، هنوز موانع متعددی در مسیر اجرای مؤثر، گسترده و پایدار این روشها در سطوح مختلف نظام سلامت وجود دارد. در این بخش، مهمترین چالشها و شکافهای علمی و عملی در این حوزه بررسی میشود.
۱. فقدان تستهای میدانی ساده و سریع (Point-of-Care)
یکی از بزرگترین چالشهای موجود، نبود یک تست نقطهای (Point-of-Care Test) است که بتواند با دقت بالا، در شرایط محدود از نظر امکانات اجرا شود. بیشتر روشهای دقیق (مانند PCR یا آسیبشناسی) نیاز به زیرساختهای پیشرفته، نیروی انسانی متخصص و زمان دارند که در بسیاری از مناطق اندمیک یا کمبرخوردار قابل تأمین نیستند.
۲. نبود کیتهای تجاری تأییدشده برای گال انسانی
بر خلاف بسیاری از بیماریهای عفونی دیگر، برای تشخیص گال هنوز کیتهای تجاری معتبر و تأییدشده در مقیاس جهانی تولید نشدهاند. این مسئله باعث شده است که استفاده از روشهای مولکولی یا سرولوژیک بهصورت پراکنده و عمدتاً در مطالعات تحقیقاتی باقی بماند و وارد عرصه بالینی عمومی نشود.
۳. پیچیدگی در نمونهبرداری و استانداردسازی آن
موفقیت بسیاری از روشهای تشخیص (مخصوصاً PCR و LAMP) به انتخاب صحیح محل نمونهگیری وابسته است. عدم استانداردسازی در نحوه نمونهبرداری (مثلاً استفاده از سوآب، خراش پوست یا بیوپسی)، میتواند منجر به نتایج منفی کاذب شود. این مسئله در گال کلاسیک بهویژه در مراحل اولیه، و در گال دلمهای بهعلت فراوانی زیاد انگل، متفاوت است و نیاز به پروتکلهای مشخص دارد.
۴. تداخل آنتیژنی با سایر کنهها در روشهای سرولوژیک
در بسیاری از آزمونهای سرولوژیک، واکنشهای متقاطع (Cross-reactivity) با کنههای محیطی مانند کنههای خانگی (Dermatophagoides spp.) گزارش شدهاند. این تداخل میتواند دقت تشخیصی را کاهش دهد و منجر به نتایج کاذب مثبت شود، بهویژه در جمعیتهایی که آلرژیهای زمینهای دارند.
۵. کمبود داده انسانی و مطالعات بالینی وسیع
بسیاری از روشهای جدید مانند LAMP، آزمونهای فلورسانس یا استفاده از آنتیژنهای نوترکیب، بیشتر بر پایه نمونههای حیوانی یا مطالعات محدود آزمایشگاهی هستند. هنوز نیاز به کارآزماییهای بالینی چندمرکزی و انسانی با حجم نمونه بالا برای ارزیابی دقت، اثربخشی، و قابلیت اجرایی این روشها وجود دارد.
۶. تمایز گونههای انسانی و حیوانی انگل
گرچه S. scabiei var. hominis مختص انسان است، اما برخی روشهای مولکولی ممکن است بهدلیل شباهت ژنتیکی با سویههای حیوانی، دقت خود را از دست بدهند. بررسی تفاوتهای ژنومی دقیق میان سویههای انسانی و حیوانی، و طراحی پرایمرها و آنتیژنهای خاص انسانی، یکی از نیازهای پژوهشی آینده است.
۷. نبود چهارچوب راهبردی جهانی برای تشخیص آزمایشگاهی
بر خلاف درمان که اکنون راهبردهای جهانی مانند MDA (تجویز جمعی دارو) برای آن وجود دارد، هنوز چهارچوبی جامع و هماهنگشده برای تشخیص آزمایشگاهی گال از سوی نهادهای بینالمللی مانند WHO یا CDC تدوین نشده است. این خلأ منجر به پراکندگی در رویکردهای تشخیصی بین کشورها و مؤسسات شده است.
نتیجهگیری
تشخیص دقیق، سریع و قابلاعتماد بیماری گال، نقشی کلیدی در کنترل مؤثر این بیماری واگیر و نادیدهگرفتهشده ایفا میکند. در حالی که معاینه بالینی و تجربه پزشک همچنان اساس اولیه تشخیص است، شواهد نشان میدهد که تکیه صرف بر معیارهای بالینی، بهویژه در جمعیتهای پرخطر یا موارد غیرکلاسیک، میتواند منجر به تأخیر در درمان یا خطا در تشخیص شود.
در این مقاله، مجموعهای جامع از روشهای آزمایشگاهی تشخیص گال بررسی شد، از جمله میکروسکوپی مستقیم، آسیبشناسی بافتی، آزمونهای سرولوژیک، تکنیکهای مولکولی مانند PCR و qPCR، و روشهای ایزوترمال مانند LAMP. یافتهها نشان دادند که هر یک از این روشها مزایا و محدودیتهای خاص خود را دارند و بسته به شرایط موجود، میتوانند بهطور تکمیلی مورد استفاده قرار گیرند.
روشهای مولکولی، بهویژه PCR، از نظر دقت تشخیصی (حساسیت و ویژگی) عملکرد بسیار خوبی دارند، اما نیازمند تجهیزات پیشرفته و نیروی متخصص هستند. در مقابل، روشهایی مانند LAMP با قابلیت اجرا در محیطهای کممنبع، چشمانداز بسیار مناسبی برای غربالگری میدانی دارند. در کنار اینها، توسعه آزمونهای سرولوژیک با آنتیژنهای نوترکیب میتواند امکان تشخیص غیرتهاجمی و سریع را در آینده فراهم کند.
با این حال، نبود کیتهای تجاری استاندارد، عدم وجود پروتکلهای بینالمللی جامع، و فقدان مطالعات بالینی گسترده، از جمله موانع اصلی پیادهسازی گسترده این تکنیکها در نظامهای سلامت است.
بنابراین، توسعه یک چارچوب چندلایه برای تشخیص گال که شامل ترکیبی از روشهای سریع، دقیق و متناسب با منابع موجود باشد، به همراه سرمایهگذاری در پژوهش، آموزش نیروهای بومی، و تقویت ظرفیت آزمایشگاهی در کشورهای با بار بالای بیماری، ضروری به نظر میرسد. تنها با چنین رویکردی میتوان امیدوار بود که بیماری گال از یک معضل نادیدهگرفتهشده به یک تهدید قابلکنترل در بهداشت جهانی تبدیل شود.
پیشنهادات
بر اساس تحلیلهای ارائهشده در این مقاله، بهمنظور ارتقاء سطح تشخیص، کنترل و مدیریت بیماری گال، پیشنهادهای زیر در سطوح مختلف پژوهشی، بالینی و سیاستگذاری قابل اجرا میباشند:
۱. توسعه تستهای سریع و قابلاستفاده در نقاط دورافتاده
ضروری است طراحی و تولید آزمونهای نقطهای ساده (POCT) با حساسیت و ویژگی بالا در اولویت قرار گیرد. استفاده از تکنولوژیهایی مانند LAMP یا lateral flow assays میتواند امکان تشخیص مؤثر را در مراکز بهداشت روستایی یا در زمان وقوع اپیدمی فراهم سازد.
۲. سرمایهگذاری در توسعه کیتهای تجاری استاندارد
ساخت کیتهای تشخیصی تجاری و اعتبارسنجیشده برای گال انسانی بر پایه آنتیژنهای نوترکیب یا نشانگرهای ژنتیکی اختصاصی، میتواند امکان بهکارگیری روشهای سرولوژیک و مولکولی را در سطح وسیعتر فراهم کند. این امر نیازمند حمایت دولتها و نهادهای بینالمللی در قالب پروژههای تحقیق و توسعه است.
۳. استانداردسازی روشهای نمونهبرداری
تدوین پروتکلهای یکپارچه برای جمعآوری نمونههای پوستی (سوآب، خراش، بیوپسی) در گروههای مختلف بیماران، بهویژه کودکان، سالمندان و بیماران با نقص ایمنی، ضروری است. این استانداردسازی برای افزایش دقت و تکرارپذیری نتایج در آزمونهای آزمایشگاهی حیاتی است.
۴. آموزش کادر درمان در سطوح مختلف
برگزاری کارگاهها و برنامههای آموزشی برای پزشکان عمومی، پرستاران و کارشناسان آزمایشگاه جهت آشنایی با روشهای جدید تشخیص گال، میتواند منجر به افزایش دقت تشخیص، کاهش انتقال داخل مراکز درمانی، و ارتقاء کیفیت خدمات گردد.
۵. حمایت از مطالعات بالینی چندمرکزی
پیشنهاد میشود مطالعات بالینی وسیع و چندمرکزی برای اعتبارسنجی روشهای نوین مانند LAMP، RT-PCR و آزمونهای ایمونولوژیک در جمعیتهای انسانی مختلف طراحی و اجرا گردد. نتایج این مطالعات میتواند مبنای تدوین راهنماهای جهانی تشخیصی باشد.
۶. تدوین سیاست ملی/بینالمللی برای تشخیص گال
ضروری است سازمانهایی مانند WHO، CDC و نهادهای منطقهای به تدوین راهنمای تشخیص آزمایشگاهی گال اقدام کنند، بهویژه در کشورهایی که بار بیماری بالا دارند. وجود چنین راهنماهایی موجب هماهنگی، تسهیل تأمین منابع و بهبود روند پاسخ به اپیدمی خواهد شد.

بدون دیدگاه